Za odkritje in razvoj zelo uporabnih, praktičnih metod za tvorbo vezi ogljik–ogljik (C–C) so leta 2010 Richard Heck, Ei-Ichi Negishi in Akira Suzuki prejeli Nobelovo nagrado za kemijo. Z izvirnimi odkritji, ki segajo nazaj v 70. leta 20. stoletja, so revolucionirali sintezne strategije ter s tem spremenili način razmišljanja sinteznih organskih kemikov tako v akademskem kot industrijskem okolju. Njihova odkritja so spremenila način, kako kemiki načrtujejo in gradijo molekule, hkrati pa omogočila nove, predhodno nemogoče, a zelo pomembne reakcije za tvorbo C–C vezi. Te metode namreč omogočajo, da se manjši gradniki povežejo v novo, večjo molekulo z novimi lastnostmi. To je predvsem pomembno pri sintezi nekaterih zdravilnih učinkovin, ki so lahko precej kompleksne molekule, zato je bila njihova sinteza pred odkritjem reakcij spajanja zelo zahtevna oziroma praktično nemogoča. Nekaj primerov je prikazanih na spodnji sliki.
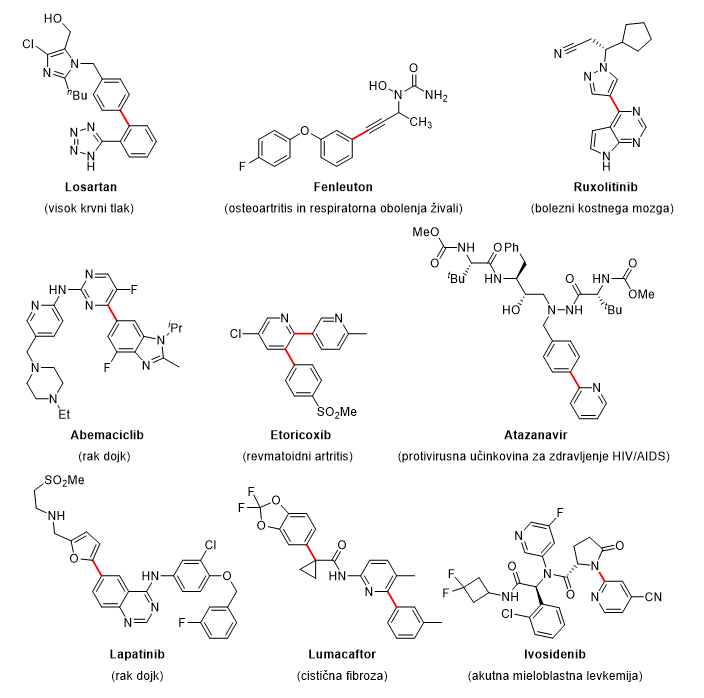
Zdravilne učinkovine in vezi, v njih pripravljene z reakcijami spajanja. (Buskes in Blanco 2020, McGrath idr. 2010, Qureshi idr. 2022)
Ciljne, želene molekule v organskem laboratoriju je mogoče pripraviti na več načinov, kar je hitro razvidno tudi iz literature, kjer je za pripravo ene spojine velikokrat mogoče najti različna zaporedja kemijskih postopkov, ki pripeljejo do istega produkta. Sintezni protokoli se med seboj razlikujejo v zahtevnosti posameznih sinteznih stopenj, kjer nekateri zahtevajo strogo kontrolirane reakcijske pogoje, posebne aparature in katalizatorje, tj. spojine, ki pospešijo oziroma sploh omogočijo potek določenih kemijskih reakcij. Postopki se razlikujejo še po ceni vhodnih surovin in vodijo do produktov v različnih izkoristkih, z različno čistostjo. Posebej zaželene so torej reakcije, ki selektivno vodijo do želenih produktov z nastankom čim manj stranskih produktov ter pod čim bolj sobnimi pogoji (brez segrevanja, ohlajanja, odstranjevanja kisika, zračne vlage, sušenja topil).
S tega vidika precej zanimiv sklop kemijskih postopkov, ki je laični javnosti relativno nepoznan, so s prehodnimi kovinami katalizirane reakcije spajanja ali na kratko kar reakcije spajanja (tudi reakcije pripajanja, angleško pa jih označujemo s terminom cross-coupling reactions). Gre za kemijske reakcije, ki potekajo v prisotnosti katalizatorjev iz prehodnih kovin in omogočajo spajanje reagentov preko tvorbe novih vezi C–C ali C–heteroatom (heteroatom je atom različen od C in je lahko na primer N, O, S), splošna shema pa je razvidna s spodnje slike. Tovrstne reakcije so zlasti pomembne za gradnjo večjih molekul z visoko dodano vrednostjo, saj so bile take metode pred odkritjem reakcij spajanja relativno omejene. Odkritje s paladijem kataliziranih reakcij spajanja pa je korenito spremenilo kemijske pristope, razumevanje in načrtovanje novih molekul ter tudi omogočilo prej nemogoče a hkrati neprecenljive postopke za tvorbo novih C–C vezi. To je precej olajšalo sintezne poti za pripravo kompleksnejših spojin, uporabnih tudi za zdravila.
Paladij, ki je pri reakcijah spajanja praktično nepogrešljiv, je dragocena kovina, ki jo je leta 1802 odkril W. H. Wollaston med procesom priprave čiste platine. Paladij takrat še ni imel uporabne vrednosti in je obveljal zgolj za kemijsko zanimivost, novo, nepoznano kovino. Ker za paladij v času njegovega življenja ni bilo dovolj zanimanja, je Wollastonu ob njegovi smrti ostal praktično ves paladij, ki ga je uspel ekstrahirati, saj ga je uspel prodati zgolj zanemarljiv delež. Tekom življenja je tako izoliral in obtičal s približno 8.5 kg »neuporabnega paladija«, ki bi bil danes vreden več kot pol milijona EUR (Griffith 2003, Kronberg idr. 2013).
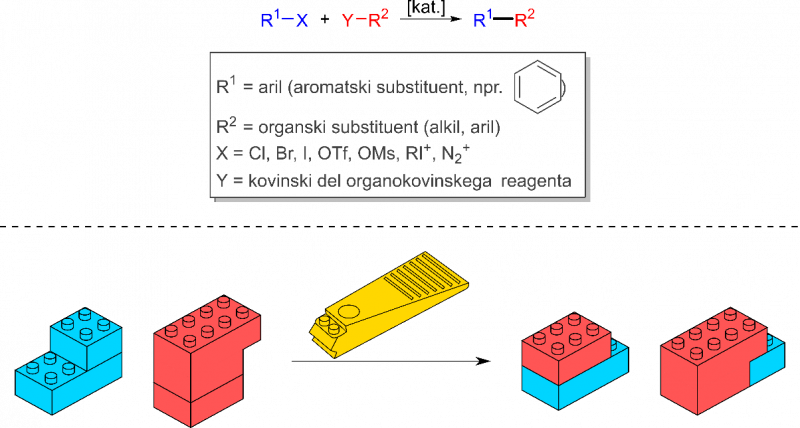
Splošna reakcijska shema za reakcije spajanja
Pri splošni reakciji spajanja se spojita organska dela reagentov R1 in R2, tako da se med njima tvori nova C–C vez. Ključno vlogo pri tem ima katalizator na osnovi dragocenih prehodnih kovin, najpogosteje paladija, ki aktivira substrate za pretvorbo. Za potek reakcije se morata namreč prekiniti vezi med R1 in X ter R2 in Y. Plastično si je to mogoče predstavljati preko analogije z lego kockami (slika zgoraj). Včasih se je potrebno precej potruditi, da se jih lahko spravi narazen in zloži v želeno strukturo. Lahko pa uporabimo kak pripomoček, ki nam sestavljanje bistveno olajša. Tako tudi katalizatorji olajšajo sestavljanje kemijskih motivov, da enostavneje pripravimo večje molekule z želenimi lastnostmi.
Bolj natančno gledano gre v reakcijski shemi na zgornji sliki za kemijsko pretvorbo aril halogenidov (modro) ali njim podobnih spojin, psevdohalogenidov, kot so triflati, mezilati ali nekatere onijeve soli (jodonijeve, diazonijeve ...), ki reagirajo na analogen način. Aril halogenidi reagirajo z ustreznimi organokovinskimi reagenti (rdeče). To so spojine, ki vsebujejo organski del molekule, v shemi označen z R2, vezan na kovinski center Y. Reakcija poteče tako, da se med posameznima deloma substratov, R1 in R2, v produktu tvori nova C–C vez. Organokovinski reagenti so v nekaterih primerih stabilni, tako da se jih v reakcijo lahko dodaja že predpripravljene. V nekaterih primerih pa se organokovinske reagente bolj splača tvoriti šele v reakcijski zmesi (in situ), tako da lahko takoj reagirajo naprej z ustreznim partnerjem. Slednje je zlasti smiselno v primeru, ko so organokovinski reagenti izredno občutljivi ali celo eksplozivni, kot na primer organski bakrovi acetilidi v primeru Sonogashirove reakcije (de Meijere idr. 2013).
Zgodovina reakcij spajanja in faze razvoja
Za boljše razumevanje reakcij spajanja je koristno poznati njihov okvirni zgodovinski razvoj, ki je zanimiv tudi zato, ker oriše način, kako pride do odkritja novih katalitskih reakcij. Prvi primeri reakcij, iz katerih so se sčasoma razvile moderne reakcije spajanja, so bili odkriti na prelomu v 20. stoletje. Šlo je večinoma za reakcije spajanja dveh enakih molekul med sabo, pospešene v prisotnosti enakih množin katalizatorjev iz prehodnih kovin, tj. v stehiometričnih količinah prehodnih kovin. Povezovanje dveh molekul preko tvorbe nove C–C vezi je med raziskovalci vzbudilo precej zanimanja zaradi praktičnega sinteznega vidika, zato so se reakcije skozi čas razvile v katalitske verzije, ki potekajo z bistveno manjšo količino dragocenih kovin in so postale splošno uveljavljeni postopki, nepogrešljivi v modernih sinteznih organskih laboratorijih. Razvoj reakcij spajanja skozi 20. stoletje jedrnato povzame spodnja slika (Johansson Seechurn idr. 2012).

Zgodovinski razvoj reakcij spajanja. Prirejeno po Johansson Seechurn idr. 2012.
Začetna odkritja so temeljila na uporabi stehiometričnih količin bakra oziroma alkalijskih in zemljoalkalijskih kovin. Dejstvo, da alkini v prisotnosti stehiometričnih količin bakrovih soli dimerizirajo med sabo, tako da se med sabo povežeta dve molekuli istega reagenta kot je razvidno s spodnje slike, je leta 1869 odkril C. A. Glaser. Kljub temu, da je metoda na začetku vključevala izolacijo potencialno eksplozivnih bakrovih acetilidov, je bila dobro sprejeta v širši kemijski srenji in skozi razvoj reakcij spajanja odprla novo področje raziskovanja.
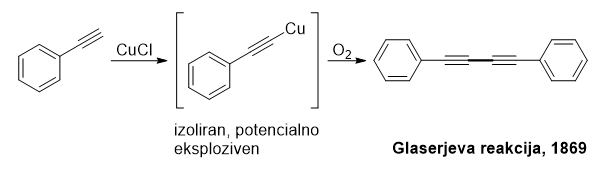
Reakcijska shema Glaserjeve reakcije dimerizacije alkinov
V naslednjih desetletjih, še posebej od začetka prve do konca druge svetovne vojne, je sledilo precejšnje zatišje na področju raziskav, povezanih z reakcijami spajanja. Po drugi svetovni vojni je nastopilo obdobje obnavljanja in s tem potrebe po čim cenejših in dostopnejših materialih. To je dalo reakcijam spajanja nov zagon. V nadaljevanju so spoznali, da so kovine tudi v manjših, substehiometričnih oziroma katalitskih količinah uporabne za pripravo želenih produktov. Skozi empirične študije so ugotovili, da je za reakcije spajanja še bolj kot baker ali nikelj uporaben paladij. Tako se je z vzponom paladijeve katalize za reakcije spajanja v 80. letih zaključila prva faza razvoja, v kateri so spoznali uporabno katalitsko vrednost kovin prehoda.
V naslednji fazi razvoja so začeli testirati uporabnost različnih organokovinskih partnerjev v reakcijah spajanja. Ti so bili sprva omejeni na organolitijeve in organomagnezijeve soli, v katerih je organski del molekule vezan na litij ali magnezij. Te organokovinske spojine pa so precej občutljive na prisotnost različnih funkcionalnih spojin na substratih. Tako so začeli iskati manj občutljive organokovinske reagente na osnovi drugih kovin in hitro se je razvila široka paleta reakcij, ki so lahko uporabljale najrazličnejše derivate, od spojin aluminija, cinka, pa vse do bora in silicija. Vsak organokovinski reagent je sčasoma definiral svoj tip reakcije, ki je za lažje razlikovanje med njimi dobila ime po znanstveniku, ki je ključno prispeval k njenemu razvoju. Posamezno ime tako običajno karakterizira organokovinski reagent oziroma kombinacijo substrata in kokatalizatorja, ki skupaj tvorita organokovinski reagent. Tako kemik ob omembi Sonogashirove reakcije takoj ve, da gre za spajanje aril halogenida z alkinom. Analogno na primer pri Suzuki-Miyaurevi reakciji ve, da gre za uvedbo novega aromatskega obroča na aril halogenid, pri čemer ima vlogo organokovinskega reagenta ustrezna borova kislina.
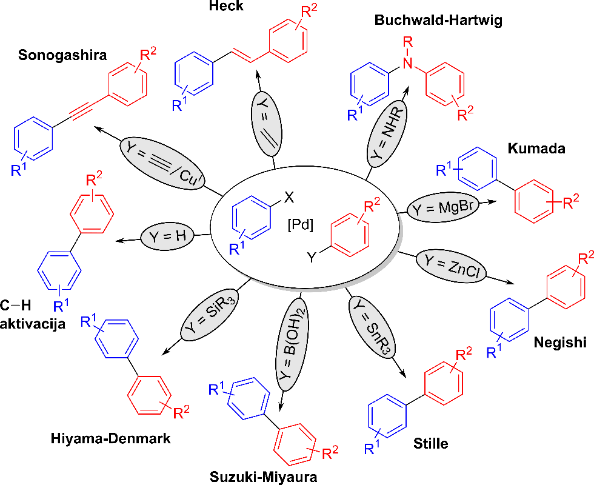
Nekaj najpogostejših reakcij spajanja v sliki
Z izčrpanjem uporabnih organokovinskih reagentov, ki so z aril halogenidi vodili do produktov, se je ob prelomu tisočletja zaključila druga faza v razvoju reakcij spajanja. V tretji fazi so se raziskave osredotočile na optimizacijo katalitskih sistemov in fine izboljšave v samih procesih. Z natančnim prilagajanjem lastnosti kovinskih katalizatorjev so dosegali vedno boljše izkoristke reakcij in z njimi pripravljali vedno bolj zahtevne produkte s povečevanjem tolerance do različnih funkcionalnih skupin in razširjanjem nabora uporabnih substratov. Izboljševanje katalizatorjev je v prvi vrsti potekalo tako, da so kovinski atom katalizatorja obdali z zaščitnimi molekulami, ligandi, ki v reakcijski zmesi objamejo kovinski katalizator in hkrati vplivajo na njegovo reaktivnost, v idealnem primeru usmerijo reaktivnost zgolj na želene izhodne spojine ter zmanjšajo reaktivnost za stranske reakcije.
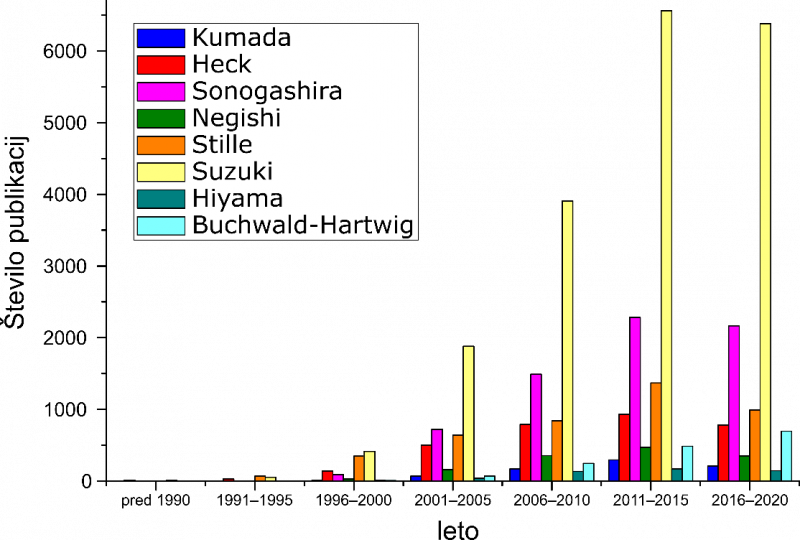
Število objav za poimenske reakcije spajanja skozi čas. Zadetki v spletnem orodju SciFinder.
Tako je področje v tretji fazi, po letu 2000, doživelo poseben razmah, kar je opaziti na zgorji sliki v domala eksponentni rasti števila novih publikacij, povezanih z reakcijami spajanja. Za večino imenskih reakcij je zanimanje doseglo vrh v petletki po podeljeni Nobelovi nagradi za to področje (2011–2015). V zadnjem obdobju, med 2016 in 2020, se je število objav nekoliko zmanjšalo, razen v primeru Buchwald-Hartwigove reakcije aminiranja, ki je bila tudi odkrita nekoliko pozneje (1994). Kljub upadajočemu trendu pa je področje reakcij spajanja še vedno precej aktivno z več kot 10.000 objavami med letoma 2016 in 2020. Opisano sosledje faz v raziskavah reakcij spajanja dobro prikaže tudi korake, po katerih se razvijejo novi sintezni postopki. Običajno raziskovalke in raziskovalci ugotovijo, da določene kemikalije/spojine pospešijo potek kemijskih reakcij. Te zato v reakcijsko zmes dodajajo v enaki količini kot reagente ali celo v presežku. Skozi optimizacijo reakcijskih pogojev ter s sočasnim raziskovanjem reakcijskega mehanizma jim uspe razviti postopke, v katerih uporabljajo minimalne količine »pospeševalnih« spojin, ki se pri reakciji v najboljšem primeru ne porabljajo. Tako se spojine iz stehiometričnih reagentov, ki omogočajo reakcijo razvijejo v katalizatorje, ki reakcijo pospešijo, vendar se pri tem ne spreminjajo. V končni fazi sledi še fino prilagajanje lastnosti katalizatorjev za doseganje najbolj učinkovitih kemijskih pretvorb.
Reakcijski mehanizem
Serija reakcij spajanja, prikazana na četrti sliki zgoraj, vsebuje na prvi pogled precej različne kemijske reakcije. Kljub temu pa je mogoče z natančnim vpogledom v reakcijski mehanizem, tj. kaj se s spojinami dogaja na molekularnem nivoju, najti neke skupne lastnosti. Katalitski cikel za te reakcije je namreč mogoče zapisati v splošni obliki tako kot je prikazano na spodnji sliki (Miyaura in Suzuki 1995, Yin in Liebscher 2007, de Meijere idr. 2013).
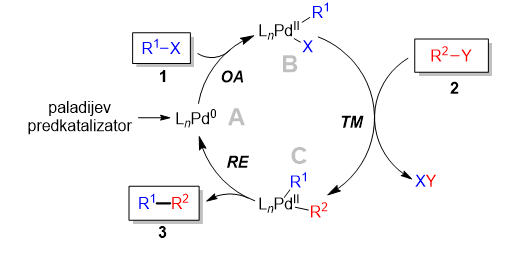
Katalitski cikel reakcij spajanja
Reakcija se začne s kovino v nizkem oksidacijskem stanju, ki je katalitsko aktivna. Na shemi je katalitska zvrst A paladij v oksidacijskem stanju 0. Kovine v takem stanju so načeloma zelo reaktivne. Po eni strani je ta reaktivnost zaželena, saj je ključna, da omenjene reakcije potečejo. V prvi stopnji namreč poteče posebna reakcija vrinjenja kovine v kovalentno vez ogljik–halogen v reagentu 1. Pri tem nastane intermediat oziroma vmesni nestabilni produkt B, v katerem je paladij v višjem oksidacijskem stanju, tj. Pd(II). Ker pri tem procesu pride do oksidacije katalizatorja, se imenuje oksidativna adicija (OA), produkt B pa analogno imenujemo oksidativni adukt.
Prej omenjena reaktivnost pa je hkrati tudi dvorezni meč, saj katalizator zaradi svoje reaktivnosti lahko reagira tudi s kakšnimi drugimi spojinami, denimo z vodo, kisikom ali kako drugo prisotno molekulo, kar vodi do poteka stranskih reakcij. Te so načeloma nezaželene, saj ob tem pride do izgubljanja katalizatorja oziroma katalitske aktivnosti, porabljanje reagentov za nastanek stranskih produktov pa vodi do slabših izkoristkov in potrebe po čiščenju končnih produktov.
Oksidativni adukt B je sedaj aktiviran za reakcijo z organokovinskim partnerjem (2), kar se zgodi v stopnji transmetalacije (TM). V tej stopnji se fragmenta, ki ju želimo spojiti (R1 in R2), preneseta na isti kovinski atom v intermediatu C. Tako prideta dovolj blizu skupaj, da se v nadaljevanju med njima lahko tvori nova vez. Z nastankom vezi med skupinama R1 in R2 nastane nova spojina, vezi s kovino pa se prekinejo. Kovina se tako reducira v začetno, nižje oksidativno stanje. Ker se kovina reducira (PdII v Pd0), produkt pa odstrani (eliminira) iz katalitskega sistema, se ta stopnja imenuje reduktivna eliminacija (RE), ki zaključi katalitski cikel tako, da vodi do nastanka produkta in regeneracije aktivnega katalizatorja, A.
Skupna lastnost reakcij spajanja je torej značilen katalitski cikel, ki vsebuje tri ključne stopnje za nastanek produkta. To so oksidativna adicija, transmetalacija in reduktivna eliminacija.
S študijami reakcijskih mehanizmov bolje razumemo, kako take kemijske reakcije potekajo, to pa nam omogoča, da ustrezno prilagodimo katalizator oziroma katalitski sistem. To je mogoče storiti tako, da kovino obdamo z dodatnimi, zaščitnimi molekulami (ligandi), ki vplivajo na njeno reaktivnost, usmerijo reaktivnost zgolj na želeno izhodno spojino, zmanjšajo reaktivnost za stranske reakcije itd. In ravno to je bilo v osredju zadnje, tretje faze razvoja reakcij spajanja (Johansson Seechurn idr. 2012).
Na meji med organsko in anorgansko kemijo
Razvoj novih kompleksov za katalize reakcij spajanja predstavlja pomembno vejo raziskav na področju organokovinske kemije, ki na meji med organsko in anorgansko kemijo združuje organske ligande z anorganskimi kovinskimi centri. Reagenti in kompleksi s prehodnimi kovinami so pomembni v moderni organski sintezi, ker omogočajo, da na videz nemogoče reakcije potekajo relativno enostavno. Take kemijske reakcije komplementarno dopolnijo »tradicionalno kemijo funkcionalnih skupin« in pomembno razširijo doseg sinteznih postopkov v organski kemiji, kar omogoča cenejši in lažji dostop do snovi, pomembnih za vsakdanje življenje kot so zdravila in materiali.















