Cepiva RNK, ki so bila še do nedavnega dokaj neznana tehnologija, so ob koncu leta 2020 postala reden del pogovorov ob kosilu ali na božični večerji. Razlog za to sta seveda pandemija covid-19 in potencialni up, ki ga cepiva prinašajo z boleznijo in pri vračanju v stanje normalnosti. Preden bomo zagotovo vedeli, ali je cepivo dovolj učinkovito za zagotovitev trajne imunosti, bo treba počakati še nekaj časa. A hitri razvoj in trženje cepiv RNK proti virusu SARS-CoV-2 podjetij Pfizer in Moderna sta prelomna z več vidikov in utegneta biti precej pomembna za izdelavo cepiv v prihodnosti. Cepiva RNK bodo tako lahko kmalu postala cepiva nove generacije in omogočila hiter razvoj cepiv proti številnim drugim nalezljivim boleznim, pa tudi izboljšala zdravljenje bolezni, kot je rak. Razumevanje, kako delujejo, bo tako pomembno ne le za razvoj novih cepiv, temveč tudi za obveščanje javnosti o znanstvenih odkritjih, zaslužnih za tehnologijo, ki bo morda v ne tako daljni prihodnosti postala del našega vsakdana.
Kaj cepiva RNK sploh so in kako delujejo?
Vsa cepiva so zgrajena iz delcev patogenov ali oslabljenih patogenov, ki sicer niso zmožni okužiti osebe, vendar so dovolj podobni dejanskemu patogenu, da izzovejo in aktivirajo naravni imunski sistem, kot bi ga pravi patogen. Pri tem se zgodi več procesov na nivoju t. i. prirojene in pridobljene imunosti, najpomembnejši končni izid, ključen za razvoj trajne imunosti ter posledično delovanja cepiv, pa je razvoj spominskih B- in T-celic proti temu patogenu. Ob ponovnem soočenju s patogenom so spominske celice sposobne aktivirati imunski odziv proti točno določenemu patogenu v kratkem času, še preden se patogen lahko v telesu namnoži in povzroči škodo.
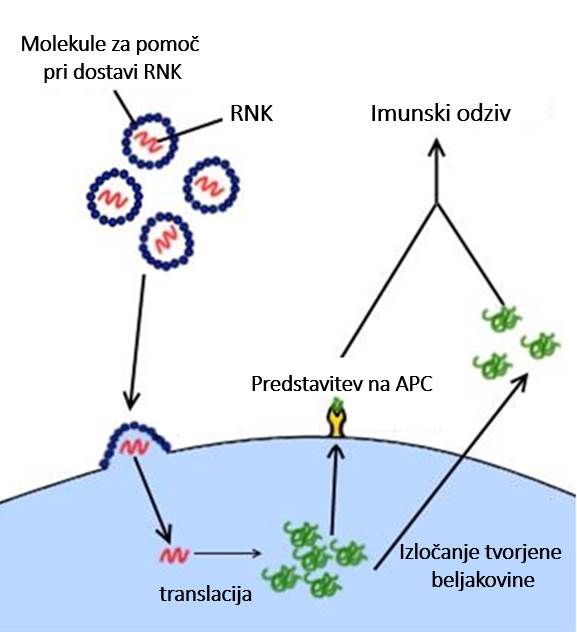
Cepiva RNK se od klasičnih cepiv razlikujejo po načinu tvorbe patogenskih delcev. Klasična cepiva vsebujejo dejanske delce patogenov, medtem ko cepiva RNK vsebujejo informacijo za beljakovinske delce v obliki molekule informacijske RNK (angl. messenger RNA oziroma mRNA), te delce pa nato tvorijo telesne celice same z naravnim procesom translacije oziroma prevoda genskega koda, zapisanega v obliki nukleotidnega zaporedja mRNK, v aminokislinsko zaporedje. Aminokisline se v celičnem okolju zvijejo v beljakovino, ki je po obliki in zaporedju identična delcu virusa ali bakterije (ali pri cepivu za zdravljenje raka beljakovine, značilne za rakaste celice). Te pa se nato predstavijo na površini antigen-predstavitvenih celic (angl. antigen-presenting cells oziroma APC), ki so specializirana oblika celic prirojene imunosti, odgovorna za nadaljnje obveščanje celic prirojene imunosti o prisotnosti patogena v telesu.
Zamenjava učinkovine v cepivu za informacijo, kako zgraditi to učinkovino, je osrednja razlika med klasičnimi in cepivi RNK, a ta mala sprememba ima odločilne prednosti. Morda najpomembnejša je hitrost izdelave takšnih cepiv. Produkcija molekul RNK je namreč veliko lažji kemijski proces kot produkcija samih patogenov ali patogenskih beljakovin. Reakcijo je mogoče izvesti s komercialno dostopnimi encimi v standardiziranih pogojih, zaradi česar je celoten postopek hitrejši in cenejši, variabilnost med končnimi produkti pa je manjša. Prav tako ni treba skrbeti za pravilno zvijanje in oblikovanje aminokislinske verige v tridimenzionalno zgradbo beljakovine, saj optimalno okolje za to ponuja celična citoplazma.
Cepiva RNK imajo prednost tudi pred drugo vrsto cepiv, ki je še nismo omenili – cepivi DNK. V centralni biološki dogmi je informacija za tvorbo celičnih beljakovin zapisana v nukleotidnem zaporedju na molekuli DNK. Ta se najprej prepiše v molekulo mRNK, ki se nato veže na ribosom (tj. na celično »mašinerijo«, potrebno za prevod informacije na RNK v aminokislinsko zaporedje beljakovine). Cepiva DNK tako delujejo podobno kot cepiva RNK s tega vidika, da kodirajo informacijo za beljakovino, vendar vključujejo še proces transkripcije oziroma prepisa DNK v RNK. A cepiva DNK so potencialno nevarna. Čeprav je molekula DNK majhna, obstaja verjetnost, da se v cepivu zaradi podobnosti v molekulski zgradbi pomotoma vgradi v genom gostiteljske celice. Takšne vstavitve so pogosto neškodljive, lahko pa so nevarne, če se vgradijo v pomembne regulatorne gene, onkogene ali tumorje zavirajoče gene.
Pri cepivih RNK takšnega tveganja tako rekoč ni, saj se molekula RNK sama ne more vgraditi v genomsko DNK: molekuli RNK in DNK sta namreč preveč različni. Prav tako so molekule RNK izredno občutljive za razgradnjo s celičnimi encimi, imenovanimi RNaze, ki so specializirani za razrez RNK. RNK se tako po nekaj dnevih, ko je že opravila nalogo tvorbe patogenske beljakovine, naravno odstrani iz celice in ne vpliva več na nadaljnje celične procese. Naše celice sicer vsebujejo encime, ki jim pravimo reverzne transkriptaze in ki lahko prepišejo RNK nazaj v DNK, vendar ti encimi niso posebej razviti za učinkovito prepisovanje molekul RNK v cepivih. Prav tako je izražanje teh encimov premajhno, da bi lahko uspešno prepisali RNK v DNK, zaradi česar je nevarnost takšne aktivnosti v cepivih RNK tako rekoč nična.
Spoznavanje specifičnih značilnosti cepiv RNK
Ideja, da bi uporabili molekule RNK kot metodo vnosa beljakovin v odrasle živali, je bila prvič preizkušena v zgodnjih 90. letih 20. stoletja. Raziskovalci so v miši vnesli molekule RNK, ki so kodirale informacijo za antidiuretični hormon vazopresin in v miših na omenjeni hormon zaznali fiziološki odziv. To je nakazovalo, da se je RNK uspešno prevedla v beljakovino. Vendar so se že v teh zgodnjih poskusih pokazale pomanjkljivosti uporabe molekul RNK za vnos beljakovin v telo. RNK je namreč, za razliko od bolj odpornih DNK in beljakovin, izredno občutljiva molekula. Že omenjeni encimi RNaze so glavni razlog za razgradnjo RNK, encimi pa so v okolju in v telesu vseprisotni, saj jih ne proizvajamo samo ljudje, temveč tudi drugi organizmi, zlasti bakterije. Razlog za to vseprisotnost RNaz je njihova vloga v boju zoper določeno skupino patogenov – virusov. Virusi po svoji zgradbi niso kaj več kot ovoj, ki v sebi nosi genetski zapis za encime, potrebne za svoje razmnoževanje in izgradnjo. A kljub njihovi enostavnosti lahko uspešna okužba z že enim virusom privede do propada gostiteljske celice in tvorbe več tisoč novih virusov, ki se jih morajo organizmi čim prej znebiti, preden lahko povzročijo škodo. RNaze so vrsta obrambe pred vsakršno tujo molekulo RNK, ki bi lahko bila virusna, kar – na žalost ali k sreči – vključuje tudi RNK v naših cepivih. Prisotnost RNaz je prav tako glavni razlog za izredno nizke temperature, potrebne za shranjevanje cepiva, saj ostanejo encimi aktivni tudi pri takih temperaturah.
RNaze pa niso edina zaščita pred virusi, ki jo premore naše telo. Celice prirojene imunosti imajo na površini in v notranjosti različne receptorje, ki zaznavajo delce, značilne za patogene. Takšna zaznava deluje kot prva obrambna linija telesa in je zadolžena za odkrivanje prisotnosti potencialno škodljivih tujkov v telesu, proti katerim nato zažene hiter, a nespecifičen napad prirojene imunosti. Tujo RNK telo z receptorji prirojene imunosti samo po sebi zazna kot tujek, zaradi česar pravimo, da je imunogena. Raziskave so pokazale, da je odziv telesa na imunogenost vnesene RNK nekoliko paradoksalen: po eni strani višja imunogenost RNK poveča učinkovitost cepiv, saj že sama RNK učinkuje kot adjuvans – to so različne molekule, ki jih dodajo v cepiva in ki okrepijo delovanje prirojenega imunskega odziva, s tem pa prispevajo k razvoju dolgotrajne imunosti. Po drugi strani lahko imunogenost RNK zmanjša učinkovitost cepiva, zato v takih primerih želimo imunogenost zmanjšati. Določena imunogenost vnesene RNK je tako lahko koristna ali pa tudi ne, odvisno od cepiva.
Tretji pomemben premislek pri razvoju učinkovitih cepiv je način dostave molekul RNK v telesne celice. Vse celice so obdane s celično membrano, zgrajeno iz fosfolipidnega dvosloja, v katerem so nameščene beljakovine in različne hidrofobne molekule. Glavni namen membrane je, da zagotavlja mejo med zunanjostjo in notranjostjo celice in tako odločilno določa, katere molekule gredo v celico in katere ne. Molekula RNK sama od sebe težko prehaja v celično membrano, zato ji je za uspešen vstop pogosto treba pomagati.
Napredek zadnjih treh desetletij od prvih vnosov mRNK v miši se je zgodil zlasti zaradi raziskovanja načinov, kako vplivati na opisane mehanizme in s tem izboljšati vstop molekul RNK v celice.
Samó izražanje ali samopomnoževanje
Virusi so po eni strani velika grožnja človeškemu zdravju, po drugi strani pa je raziskovanje bioloških mehanizmov virusov ključno prispevalo k razvoju modernih bioznanosti in medicine. Virusi so izredno majhni, kar med drugim pomeni, da je lažje razumeti njihove gradnike. Ker je virusni »življenjski« cikel razmeroma preprost, je virus specializiran za le dve glavni nalogi – vstop v gostiteljsko celico ter hitro namnožitev. Kot smo že opisali, sta to tudi značilnosti, ki ju želimo od cepiv RNK, zaradi česar so se kmalu po prvih raziskavah cepiv RNK pojavile ideje o kombiniranju cepiv z virusnimi vektorji. Za uporabo cepiv RNK so zlasti zanimivi virusi, katerih genom je zgrajen iz molekule RNK. Genom teh RNK-virusov vsebuje strukturne gene za beljakovine ovoja in kapside virusa ter gene za pomnoževanje virusnega genoma. Z zamenjavo strukturnih genov za gene poljubne beljakovine cepiva RNK je raziskovalcem uspelo ustvariti t. i. samopomnoževalno mRNK (angl. self-amplifying mRNA oziroma SAM), ki se v celici lahko pomnožuje zaradi genov za pomnoževanje, a hkrati ne tvori novih virusov. Takšno cepivo lahko že v majhnih količinah proizvede veliko končnega produkta in izzove močan imunski odziv zoper tarčno beljakovino. Dodatna prednost takšnih cepiv je, da se pri pomnoževanju RNK tvori dvoverižna molekula RNK, ki učinkuje kot močan adjuvans, kar dodatno okrepi delovanje prirojenega imunskega odziva in posledično delovanje cepiv.
Tako samopomnoževalna RNK kot tudi RNK brez dodanih genov za pomnoževanje (angl. non-replicating mRNA oziroma NRM) pa se morata biti zmožni uspešno prepisati v beljakovino, ko prideta v celico. Danes vemo, da molekula RNK ni zgolj pasivna prenašalka informacije med DNK in beljakovinami, temveč ima tudi sama pomembno regulatorno vlogo v številnih procesih. Če ostanemo zgolj pri prepisovanju nukleinskega zaporedja v aminokislinsko, so za uspešno prepisovanje pomembni dodatni predeli, oziroma regije, na sami molekuli mRNK, ki ne kodirajo določene beljakovine. Tako imenovane neprevedene regije (angl. untranslated regions oziroma UTR) so tako pred delom RNK, ki kodira beljakovine, kot tudi za njim, vsi pa odločilno vplivajo na to, kako se bo beljakovina izražala. To nadzorujejo z več mehanizmi, glavni pa so zaščita molekule pred razgradnjo ter vezava ustreznih celičnih beljakovin, ki vodijo prevajanje in zagotavljajo stabilnost molekule. Z analizo UTR številnih organizmov in virusov ter modifikacijo naravno prisotnih zaporedij je raziskovalcem z leti uspelo sestaviti kombinacije regulatornih zaporedij, ki vodijo do izredno močnega izražanja beljakovin iz dane molekule RNK, veliko močnejšega, kot ga premorejo lastne človeške molekule RNK.
Učinkovito sprejemanje RNK
Gola molekula RNK torej bolj slabo prehaja v celično membrano, zato ji moramo pogosto pomagati, če želimo, da uspešno vstopi v citoplazmo, kjer se šele lahko izrazi. Eden od načinov za izboljšanje sprejetja je fizikalna metoda elektroporacije, pri kateri s kratkimi električnimi pulzi kratkotrajno ustvarimo pore na celični membrani. Skoznje lahko nato potuje naša poslana molekula RNK. Ta metoda je uporabna zlasti v laboratorijskih pogojih, pri katerih celice najprej izoliramo iz telesa in jih nato elektroporiramo v nadzorovanem okolju. Elektroporacija celic v telesu pa je zahtevnejši proces, saj pogosto težko dovedemo električni tok do tarčnih celic. Prav tako ne bi bilo praktično zahtevati od ljudi, naj po cepljenju ostanejo na dodatnem tretmaju z elektrodami, razen če to ne bi bilo res nujno. Omenimo lahko, da se je za zdravljenje nekaterih bolezni, na primer raka, pristop dostave cepiv RNK v izolirane antigen-predstavitvene celice izkazal za učinkovito strategijo vnašanja RNK in razvijanja priučenega imunskega odziva zoper rakave celice določenih vrst raka.
Da bi dosegli učinkovitejšo dostavo RNK v celice, so se pri številnih raziskavah osredotočili na to, kako v cepivo dodati različne molekule, ki izboljšajo privzem RNK v celice. Te molekule so pogosto različni nabiti delci, ki omogočajo pritrjevanje RNK na celično membrano, lahko pa so podobni molekulam celične membrane. Tako imenovani lipidni nanodelci tvorijo, podobno kot celična membrana, lipidni ovoj okrog molekule RNK. Dodatna prednost pakiranja RNK v različne lipidne molekule in druge polimere je ta, da tako postanejo nedostopne že omenjenim encimom RNAze, s čimer so dodatno zaščitene pred razgradnjo.
Več ni vedno bolje
Vsi opisani pristopi za izboljšanje pomnoževanja RNK, izražanja beljakovin, večanje imunogenosti, preprečevanje razgrajevanja in izboljšanje vstopa v celico niso nujno vedno tudi optimalni za delovanje cepiva. Biologija organizmov je namreč bolj kompleksna, zaradi česar včasih nastavitev vseh omenjenih mehanizmov na maksimalno delovanje ne pripelje nujno do najboljšega delovanja cepiva. Kot smo videli, nekatera cepiva učinkujejo bolje, če so bolj imunogena, druga pa, če so manj. Včasih je treba zagotoviti samopomnoževanje molekule RNK, včasih pa je že osnovna doza RNK v cepivu dovolj, da izzove močan imunski odziv. Nazadnje je pomembno to, ali cepivo deluje dobro ali ne, za kar pa so potrebne dolgotrajne študije na živalskih modelih in, če gre vse po sreči, na ljudeh v kliničnih testiranjih.
A obvladovanje posameznih lastnosti, ki določajo delovanje cepiva, je ključno za zagotavljanje uspešne imunizacije ter za soočanje s posameznimi težavami na poti k razvoju cepiva. V prihodnje bodo metode nedvomno še napredovale in že v tem članku nam ni uspelo omeniti marsikaterega dela razvoja cepiv RNK. Ker je bila uporaba teh cepiv do sedaj omejena na manjše poskuse, smo kljub obetavnim rezultatom še previdni pri vpeljevanju nove tehnologije. Vendar bodo hitrost razvoja in proizvodnje cepiv RNK, njihova varnost ter nizka cena izdelave nedvomno močni argumenti za postopno sprejetje nove generacije cepiv, zlasti v luči trenutne pandemije, pa tudi še prihajajočih epidemij. Uporaba cepiva proti SARS-CoV-2 je tako prelomna točka, ki je ne le tlakovala pot uporabi cepiv RNK, temveč bo morda tudi odločila, kako dostopna bodo ta v prihodnje. Podatki kažejo, da so cepiva RNK varna in učinkovita. Če se bodo izkazala za učinkovita tudi na globalni ravni, bomo zagotovo vedeli, da smo na pragu nove dobe cepiv.