Če bi vam kdo omenil izraz »biofilm«, obstaja velika verjetnost, da boste rekli – če niste ravno biolog –, da tega izraza ne poznate niti ne veste, kaj pomeni. Če bi se poskušali izviti in bi ugibali, da gre za filme s tematiko bioterorizma, bi udarili v prazno. Ampak ne povsem ... V resnici se z biofilmi v vsakdanjem življenju srečujemo pogosteje, kot se tega zavedamo. Za začetek se bomo omejili na bakterijske biofilme, čeprav so v biofilmih pogosto prisotni tudi ostali mikroorganizmi. Pod mikroorganizme poleg bakterij namreč štejemo tudi enocelične glive, enocelične živali in enocelične alge. Enocelični mikroorganizmi so sposobni hitro spreminjati svoj genom, zaradi česar je njihova evolucija hitra in zanimiva za raziskovanje. Poleg tega je za njimi dolga evolucija, saj so bili prvi organizmi na Zemlji pogosto v obliki biofilmov.
Biofilm imenujemo skupek bakterij, ki raste v slojih, podobno kot celice rastejo v večceličnih organizmih. Za razliko od evkariontskih celic se bakterije zlepijo druga z drugo tako, da v neposredno okolje izločajo »lepilo« iz sladkorjev, proteinov, lipidov in DNK. Tesna povezanost bakterij vzpostavi pogoje za izmenjavo posebnih hormonom podobnih molekul, ki so orodje za sodelovanje v običajnih pogojih, komunikacijo in medsebojno pomoč v stresnih pogojih. V angleščini sistem komuniciranja preko molekul imenujejo »quorum-sensing«. S takimi molekulami lahko zaznavajo tudi, kako blizu so druge bakterije, koliko jih je ter koncentracijo hranil v okolju. Podobno kot ljudje tudi bakterije s sodelovanjem lažje preživijo stresna obdobja. Za bakterije je stres lahko že velika sprememba temperature ali pH-ja, pomanjkanje hranil in prisotnost antibiotika.
V okolju obstajajo človeku koristni biofilmi in tisti, katerim se želimo v širokem loku izogniti. Koristne bakterije v obliki biofilmov najdemo v črevesju in na koži, kjer med drugim skrbijo za pH ravnovesje, preprečujejo razrast patogenih bakterij in sintetizirajo vitamine, ki jih sami ne moremo. Znebiti se vseh bakterij v človeškem telesu prav gotovo ne bi bilo dobro za naše zdravje. Biofilme pogosto uporabljamo tudi pri pripravi fermentiranih živil, od domačih jogurtov, alkoholnih pijač, kisa pa vse do eksotične in danes tako popularne kombuče (s posredovanjem angl. kombucha prevzeto iz japonščine). V človeškem telesu in okolici pa najdemo tudi biofilme, ki nam povzročajo preglavice. Kot nečistoče jih hitro opazimo na gumijastih tesnilih pralnega ali pomivalnega stroja, v obliki zobnega kamna, ali pa so bolj skriti, kot denimo infekcije vsadkov ter endoprotez. Tudi za skrite infekcije spodnjih sečil so zaslužni bakterijski biofilmi. Ena izmed takih bakterij je uropatogena bakterija Escherichia coli (E. coli), ki povzroči 70 % vseh infekcij sečil. E. coli v zdravem človeškem telesu najdemo v črevesju. Tam ne povzroča obolenj, temveč je celo koristna. Problem se pojavi, ko ta ista bakterija zaide iz črevesja v spodnji del sečil. Tam nepovabljena vstopi v celice stene sečil (epitelij) in tvori biofilme, ki povzočijo vnetje, za katero pogovorno uporabljamo termin »prehlajen mehur«.
Pregovor »kar te ne ubije, te okrepi« velja tudi za bakterije
Zakaj so torej večji problem za zdravljenje infekcije skupki bakterij v obliki biofilmov kot pa posamične bakterije? Nevarnih bakterij, ki povzročajo bolezensko stanje, se je lažje znebiti, če so posamezno, v planktonski obliki. Ko se med seboj tesno povežejo s svojimi izločki in tvorijo biofilm, antibiotiki v notranjost biofilma težko prodirajo.
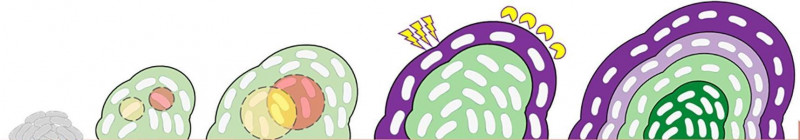
Faze rasti biofilma. V zrelem biofilmu so označeni zunanji in notranji sloji bakterij. Privzeto po: https://doi.org/10.3389/fmicb.2019.01908.
Antibiotik na mestu infekcije z biofilmom uspešno uniči zunanje sloje bakterij. Do srednjih slojev biofilma prodira v nekoliko nižji koncentraciji, kar pomeni, da je manj uspešen pri odstranjevanju bakterij. Do slojev v središču biofilma pa prodira v tako nizki koncentraciji, da ne ubije bakterij, kar pomeni, da bakterije lahko razvijejo odpornost na antibiotik. Najhitrejši način razvijanja odpornosti bakterij je privzem odpornih genov bližnjih bakterij. Geni za odpornost so iz ene bakterije v drugo pogosto preneseni z manjšimi molekulami DNK, ki jim pravimo plazmid. Plazmidi so namreč dovolj majhni, da jih lahko bakterije prenašajo preko odprtin v celični steni ali pilusov. Odporni geni lahko aktivirajo sisteme za inhibicijo antibiotika, črpanje antibiotika iz bakterijske celice ali spremenijo molekulo antibiotika, da se ta ne more vezati na svojo tarčo. Ko patogene bakterije v našem telesu pridobijo odpornost na antibiotično zdravilo, zdravnik izgubi najboljšega vojaka za boj proti infekciji. Če v celicah stene naših sečil ostajajo E. coli biofilmi po zdravljenju z antibiotikom, to privede do kroničnih obolenj in zapletenih infekcij drugih organov, na primer ledvic. Zato se raziskovanje razvoja antibiotikov usmerja k načinom, kako biofilm najprej razgraditi in nato uničiti patogene bakterije.
Z evolucijo nad bakterijske biofilme
Odpornost na antibiotike je pri bakterijah možna zaradi njihovega hitrega prilagajanja na zunanje okolje in zaradi njihovega učinkovitega medsebojnega sodelovanja. Sposobnost hitrega prilagajanja bakterij in posledično hitra evolucija pomenita, da so zmožne preživeti v neugodnih razmerah, kot je prisotnost antibiotika ali pomanjkanje hranil v neposredni okolici. Prilagajanje bakterij je tako hitro zaradi njihove preprostosti in kratkega medgeneracijskega časa. Pri človeku je čas med dvema generacijama približno dvajset let, bakterije pa se v povprečju delijo vsakih dvajset minut. Mehanizmi molekularne evolucije delujejo na nivoju DNK, zato evolucijskim spremembam sledimo s preiskovanjem genoma organizma. Vsaka nova generacija prinese možnosti za mutacije in pojavljanje novih genov, kar pomeni, da se novi geni stalno pojavljajo in izginjajo, s čimer bakterije pridobivajo ter izgubljajo nove funkcije. Če nova funkcija ni uporabna za prilagoditev bakterije ali je celo škodljiva, sprememba v genomu izgine skupaj z bakterijo ali se preko naslednjih generacij pretvori v uporabno spremembo. Mutacije so posledica spontane evolucije, ki se izoblikuje pod pritiski naravne selekcije. Z naravno selekcijo se bakterije prilagajajo na okolje, da jih preživi čim večje število. Poznamo nevtralne, pozitivne in negativne mutacije. Nevtralne mutacije nimajo vpliva na sposobnost preživetja organizma. Pozitivne mutacije bakteriji dajo nišno prednost, negativne mutacije pa v najslabšem primeru povzročijo bakterijsko smrt, v najboljšem pa bakterije izgubijo določen gen in z njim funkcijo. Nišna prednost pomeni, da ima določena bakterija zaradi hitre prilagoditve večjo možnost preživetja v določenih pogojih okolja glede na ostale organizme, ki jo obkrožajo. Organizmi, ki hitreje najdejo hranila, so spretnejši pri izogibanju plenilcem in boleznim, imajo več možnosti za prenos dednega materiala v naslednje generacije. Bakterije v biofilmih imajo zaradi svoje povezanosti posebej dinamično evolucijo, ki je zato zanimivejša za proučevanje. Bližina drugih bakterij pomeni več možnosti za privzem raznolike DNK iz okolja. Poleg tega evolucija genoma bakterij teče tudi s prenosom DNK med bakterijami ali pa se že obstoječi gen v bakteriji spremeni z mutacijami ali preurejanjem znotraj genoma.
Evoluciji bakterije sledimo z določanjem starosti genov in potjo njihovega razvoja, čemur sledimo preko mutacij posameznih nukleotidov. Na primer, primerjamo dva gena v različnih organizmih, ki sta si med seboj podobna po DNK sekvenci, vendar nista enaka. V nekem trenutku v zgodovini so se v njuni sekvenci pričele kopičiti mutacije, ki jim pravimo substitucije. Evolucijski modeli temeljijo na ideji, da več substitucij pomeni, da je preteklo več časa od zadnjega skupnega prednika izbranega gena.
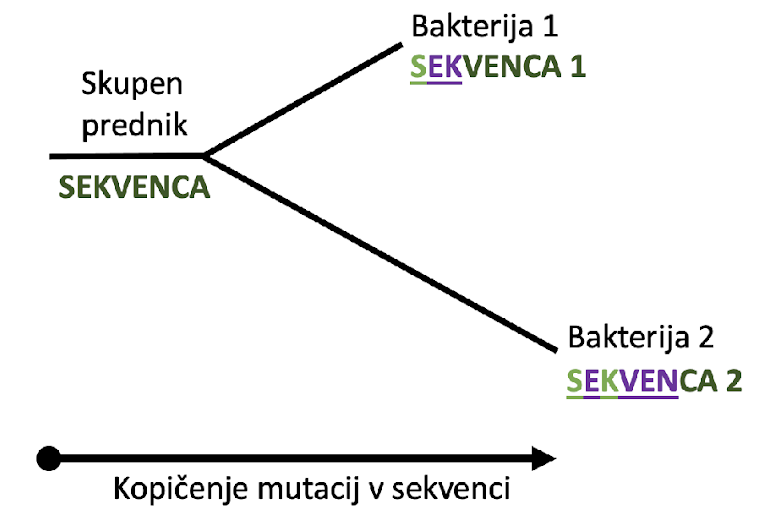
Potek evolucije sekvence DNK s kopičenjem mutacij. Mutacije so označene z vijoličnimi in svetlo zelenimi črkami.
Večinoma hkrati preverjamo evolucijo celotnega seta genov v bakterijskem genomu, zato potrebujemo zaradi nakopičenja podatkov, ki jih sami ne moremo predelati, zmogljive računalnike in znanje bioinformatike. Starost gena v teku evolucije lahko uporabimo za napoved njihove funkcije in obratno. Če najdemo gen, ki povzroči infekcijo, je to pomembno znanje, s katerim lahko bakteriji odvzamemo sposobnost povzročanja bolezni. Če pa funkcije določenega gena v celici ne poznamo, lahko izsledimo, kdaj v zgodovini se je gen pojavil, ter ga povežemo s funkcijo, ki jo je organizem v tistem trenutku razvil. Na primer, v nekem trenutku v zgodovini določena bakterija ni bila sposobna preživeti pri ekstremnih pogojih. Ker so ekstremni pogoji trajali daljše obdobje, so organizmi počasi kopičili mutacije; bakterije, ki se niso uspele prilagoditi, niso preživele. Ena od bakterij, ki je preživela, je Bacillus subtilis (B. subtilis), saj je pridobila gene za sporulacijo. Sporulacija je proces prilagajanja na ekstremne pogoje, ob katerem bakterija zaščiti svojo DNK in razvije močnejšo celično steno. Starost sporulacijskih genov tako povežemo s trenutkom, ko je ta vrsta bakterije pridobila nove gene in se tako ločila od ostalih bakterijskih vrst, ki sporulacije niso zmogle. Lei Shi in sodelavci so vse gene bakterije B. subtilis najprej razdelili v skupine glede na njihovo starost. Geni za sporulacijo so vzniknili naenkrat, ko je bakterija zaradi naravne selekcije potrebovala to funkcijo, zato so jih našli znotraj ene skupine. Gre za princip, po katerem gene z določeno starostjo lahko povežemo s funkcijo, ki jo je v tistem času pridobil organizem. S pomočjo evolucijskih modelov so izračunali verjetnost za različne poti, po katerih je gen pridobival mutacije in s tem nove funkcije. Matematični modeli, ki računajo dinamiko evolucije, so sicer lahko zapleteni, a njihova osnovna ideja je, da poskušajo glede na število mutacij v genu in s primerjanjem razvoja podobnih genov v drugih organizmih določiti izvor in starost gena.
Željen rezultat raziskovanja patogenih biofilmov in njihove evolucije je najdba novih genov v bakteriji, ki bi bili lahko izhodišče za razvoj novih antibiotikov. Zdravilo bi vplivalo na zmožnost bakterijskega gena, vpletenega v patogenezo ali razvoj biofilma, da se izraža in opravlja svojo funkcijo. Tako bi bakterija izgubila sposobnost infekcije ali tvorbe biofilma, kar bi izboljšalo učinkovitost zdravljenja. Poleg tega pa bo raziskovanje evolucije biofilmov prineslo splošno znanje o delovanju bakterij znotraj razvijajočega se biofilma. Lansko leto je bil objavljen članek o odkritju, da je izražanje genov bakterij B. subtilis znotraj biofilma razdeljeno v različne faze razvoja biofilma podobno kot pri evkariontskih embrijih. Evolucijsko starejši geni imajo pomembno vlogo v začetnih fazah biofilma, evolucijsko mlajši geni pa se aktivirajo v končnih fazah biofilma. V laboratorijskih pogojih z omejenimi hranili B. subtilis biofilm preide do končnih faz zorenja biofilma v roku dveh mesecev. S tem so znanstveniki dokazali, da je delovanje bakterij znotraj biofilma bolj organizirano in usklajeno, kot smo sprva mislili. Organizirane sisteme pa je lažje nadzorovati in spreminjati.