Od konca mednarodnega projekta sekvenciranja človeškega genoma mineva dvajset let. Projekt je s sekvenciranjem določil zaporedje, v katerem so nanizani osnovni gradniki naše DNK, ti pa so abeceda, s katero so zapisane lastnosti, ki jih podedujemo od svojih prednikov. Če bi prešteli vse črke našega genoma, bi jih našteli prek 3 milijarde – dovolj jih je za okrog deset tisoč Tavčarjevih Visoških kronik! Zaključek tega izjemno ambicioznega projekta so, primerno optimizmu ob začetku novega tisočletja, pospremile drzne napovedi o neslutenem napredku genetike in medicine. Še danes mnoge od teh obljub ostajajo neuresničene, nekatere zaradi pretiranih pričakovanj, druge pa se bodo zaradi zamika med znanstvenimi odkritji in njihovo uporabo izpolnile šele v prihodnosti. Hkrati pa je sekvenciranju prvih genomov sledil eksponenten napredek drugje: v sami tehnologiji določanja nukleotidnih zaporedij. V le dveh desetletjih je cena sekvenciranja človeškega genoma padla za milijonkrat. Četudi nam družinski zdravniki zdravljenja še ne predpisujejo na podlagi naših genomskih posebnosti, pa na določenih področjih medicine, kot je onkologija, genomski podatki posameznega bolnika ali tumorskega tkiva vse bolj usmerjajo potek zdravljenja. Seveda pa genomika še zdaleč ni omejena le na človeka, temveč se je uveljavila na številnih področjih ved o življenju, med katerimi zagotovo izstopa tudi mikrobiologija. Navsezadnje sekvenciranje celih genomov že lep čas omogoča povsem nove dimenzije razumevanja nekaterih patogenov in epidemij, vključno z virusom SARS-CoV-2 in aktualno pandemijo COVID-19. Prava eksplozija različnih tehnologij visokozmogljivega sekvenciranja je odločilno prispevala k temu, da danes sekvenciramo hitreje, ceneje in v večjem obsegu, kot smo si pred dvema desetletjema upali celo sanjati. S tem pa so se vrata v genomiko široko odprla tudi raziskovalnim področjem, ki jim namenjamo bistveno manj denarja kot raziskavam človeka in njegovih bolezni.
Onkraj človeka
Človeški genom ni bil prvi v celoti sekvenciran organizem. Tisočkrat manjši genomi bakterij, še prej pa genomi virusov, so zaradi svoje kompaktnosti predstavljali manjši izziv in so bili zato v celoti razvozlani že več let prej. Genom prve prostoživeče bakterije, Haemophilus influenzae, je bil določen že leta 1995, genom prvega evkariontskega organizma, kvasovke Saccharomyces cerevisiae, pa le leto zatem. Tako bakterija z manj kot dvema milijonoma baznih parov velikim genomom kot kvasovka z dvanajstimi milijoni sta bili sicer v primerjavi s tremi milijardami baznih parov človeškega genoma malenkost, a sta bila v kontekstu takratne tehnologije nedvomno izjemna dosežka. Sledile so druge vrste, sprva modelni organizmi, nato tudi drugi. Ozko grlo so medtem zaradi hitrega tehnološkega razvoja in vse večje konkurence ponudnikov storitev sekvenciranja vse manj tehnične in finančne zahteve projektov ter vse bolj specialistično znanje, potrebno za analizo velikih količin podatkov. Zaradi svoje enostavnosti sekvenciranje prokariontskih genomov postaja vsakdanje opravilo, med evkariontskimi genomi pa še vedno prevladujejo medicinsko in ekonomsko pomembne vrste. Tak razvoj sicer ni nepričakovan niti ni nesmiseln, vendar pa podobno kot druge aplikativno naravnane raziskave pomeni tudi zamujene priložnosti za temeljna biološka spoznanja in preboje v razumevanju živega sveta okrog nas.
Od jedrskega orožja do cepiv
Pa vendarle sekvenciranje genomov že od vsega začetka spremljajo tudi nepričakovana znanstvena vprašanja. Če se za trenutek vrnemo čisto k začetkom tri milijarde dolarjev vrednega mednarodnega projekta sekvenciranja človeškega genoma, ugotovimo, da pobuda zanj ni nastala v kateri od zdravstvenih ustanov, temveč na Ministrstvu za energetiko ZDA. To je bilo odgovorno za številne megalomanske znanstvene projekte že vsaj od Projekta Manhattan, v okviru katerega je med drugo svetovno vojno nastalo prvo ameriško jedrsko orožje. Orožarski in genomski projekt pa sta si poleg ambicioznosti delila še nekaj: pobudo za sekvenciranje človeškega genoma so vsaj sprva utemeljili z iskanjem genetskih učinkov ionizirajočega sevanja na naš dedni material. V okviru raziskav učinkov ionizirajočega sevanja je v devetdesetih letih prejšnjega stoletja nastal še en projekt. Leta 1999 je bil objavljen genom bakterije Deinococcus radiodurans, najbolj na sevanje odpornega organizma, kar jih poznamo – bakterija skoraj brez težav preživi tisočkrat večje akutne doze sevanja kot človek. S to objavo se je po eni strani pričela genomika ekstremofilnih organizmov, po drugi strani pa so raziskovalci D. radiodurans prehodili pot, podobno sekvenciranju človeškega genoma, od visokoletečih obljub prek številnih razočaranj do izjemnih odkritij. Kmalu po sekvenciranju je postalo jasno, da geni, povezani s popravljanjem poškodb DNK v D. radiodurans, niso nič posebnega. Prav tako se je izkazalo, da celice te bakterije preživijo visoke koncentracije reaktivnih zvrsti kisika, ki nastanejo zaradi sevanja, s povsem običajnim naborom encimov. Še več, inaktivacija ključnih encimov za pretvorbo reaktivnih zvrsti kisika, kot je superoksid dismutaza, ni prav nič zmanjšala tolerance na sevanje. To nepričakovano ugotovitev so raziskovalci razložili z morebitnimi neznanimi ali neprepoznanimi encimi za popravljanje s sevanjem povzročenih poškodb in blaženje oksidativnega stresa, vendar leta raziskav, vključno s preučevanjem izražanja genov in številnih mutant bakterije, te hipoteze niso potrdila. Namesto tega se je izkazalo, da celice D. radiodurans kopičijo velike količine ne-encimskih antioksidantov z nizko molekulsko maso, v katerih ključno vlogo igra mangan, s temi antioksidanti pred poškodbami zaščitijo celične beljakovine (in ne DNK!), med temi proteini pa so tudi (čisto običajni) encimi, ki popravijo poškodovano DNK in s tem celicam omogočijo preživetje.
To odkritje je vodilo do dveh nepričakovanih rezultatov, ki pričata o pogosto podcenjenem potencialu temeljnih raziskav kot gonilu napredka. Raziskovalci so pokazali, da je s pomočjo informacij o antioksidantih v bakteriji D. radiodurans mogoče pripraviti sintetično zaščitno mešanico, ki pri visokih dozah sevanja uniči DNK v obsevanem vzorcu, ohrani pa imunogenost v vzorcu prisotnih proteinov – s čimer je mogoče na enostaven način pripraviti cepivo iz celotnih inaktiviranih patogenov. Vzporedno s tem odkritjem je ista skupina v sodelovanju z našim laboratorijem ugotovila, da je vsebnost majhnih ne-encimskih kompleksov z manganom v celicah ključni indikator občutljivosti na ionizirajoče sevanje, ne le pri prokariontih, temveč tudi pri glivah in celo pri človeških celicah. Posledično lahko z meritvami vsebnosti in oblike mangana v celicah napovemo njihovo preživetje po obsevanju, kar prej ni bilo mogoče. To pa morda lahko pripomore celo k ustreznejšemu individualnemu prilagajanju radioterapije rakavih tumorjev.
In do novih ekstremov
Kaj nekaterim vrstam omogoča rast v razmerah, ki so za večino organizmov zaradi svoje ekstremnosti smrtonosne? Primerov ekstremnih okolij je dolga vrsta, od zelo eksotičnih pa do takšnih, s katerimi se srečujemo vsak dan. To so na primer soline in ledeniki, vroči vulkanski vrelci, puščave, pa tudi marmelada, kisle kumarice in soljeno suho meso. Sladkanje, soljenje, sušenje, kisanje, hlajenje – vse to so zvijače, s katerimi že tisočletja varujemo hrano pred kvarjenjem, ravno zato, ker večina mikroorganizmov v takšnih pogojih ne preživi. Nekateri pa se vendarle znajdejo tudi v takšnih neprijaznih razmerah – skoraj vsakemu od nas se je najbrž že kdaj na še tako sladki marmeladi razrasla plesen. Zakaj so ti organizmi »boljši« od drugih? To vprašanje si v naši raziskovalni skupini zastavljamo že vrsto let, predvsem z raziskavami gliv iz ekstremnih okolij. Tako smo se pred dobrim desetletjem med prvimi na svetu lotili tudi sekvenciranja genomov gliv iz ekstremnih okolij. Poleg tega, da so nam bili v veliko pomoč pri načrtovanju laboratorijskih poskusov, so nam ti prvi sekvencirani genomi odgovorili na nekatera vprašanja – in nam hkrati zastavili številna nova. V genomu na sol izjemno tolerantne črne kvasovke Hortaea werneckii smo na primer opazili pomnožitev genov za membranske črpalke ionov anorganskih soli, zlasti natrijevih in kalijevih. Takšne črpalke so ključne za ohranjanje ustreznih znotrajceličnih koncentracij različnih ionov kljub ekstremnim koncentracijam izven celice. A v genomu poliekstremotolerantne (tolerantne na številne stresne dejavnike) črne kvasovke, Aureobasidium pullulans so ti geni še številčnejši in bolj raznoliki, četudi ta vrsta prenese nižje koncentracije soli. In v evolucijsko zelo oddaljeni glivi Wallemia ichthyophaga, ki raste celo v raztopinah, nasičenih z NaCl, je število genov za ionske črpalke povsem povprečno.
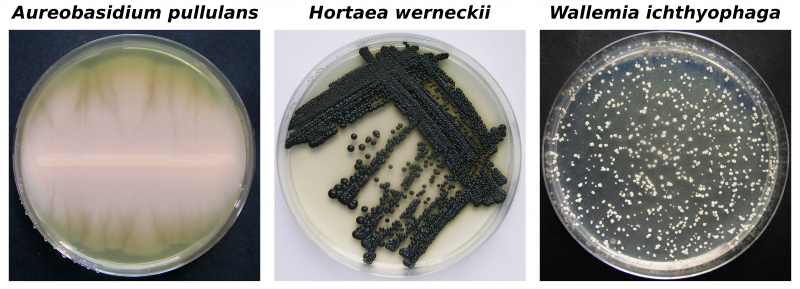
Glive, ki rastejo pri visokih koncentracijah soli: Aureobasidium pullulans (levo) raste v razponu 0–17 % NaCl (m/v), Hortaea werneckii (sredina) pri 0–30 % NaCl (m/v), Wallemia ichthyophaga (desno) pa od 10 % (m/v) do nasičenih raztopin NaCl.
Seveda smo poleg tega odkrili tudi številne zanimive lastnosti omenjenih gliv: H. werneckii je nenavaden hibrid dveh presenetljivo različnih kopij genomov; A. pullulans vsebuje ogromno število genov za zunajcelične encime, kar se sklada s sposobnostjo razgrajevanja številnih substratov; W. ichthyophaga ima izredno kompakten genom z manj geni kot mnoge bakterije, hkrati pa celo vrsto genov za hidrofobine, majhne proteine s številnimi možnostmi uporabe v industriji. Pa vendarle opisani primer ionskih črpalk zastavlja vprašanje, v kolikšni meri je lastnost, kot je ekstremotoleranca, sploh mogoče razložiti s pomočjo genomskega zaporedja. Koliko genov soustvarja takšen fenotip in ali jih znamo prepoznati? Ali gre za »učinkovitejše« različice genov, udeleženih v odgovor na stres pri modelnih organizmih, ali za povsem druge gene, ali pa celo za mehanizme, kot je kopičenje ne-encimskih antioksidantov z manganom pri bakteriji D. radiodurans, ki jih je izjemno težko povezati celo s posebnostmi v izražanju genov, kaj šele z zaporedjem samega genoma. In še: glede na to, da se je ekstremotoleranca neodvisno pojavila na različnih delih drevesa življenja, ali je v vseh primerih sledila podobnemu načrtu, ali pa je evolucija v različnih organizmih iznašla različne rešitve? Takšna in podobna vprašanja si lahko zastavimo tudi v primeru drugih kompleksnih fenotipov. Sposobnost povzročanja oportunih okužb človeka opazimo pri številnih glivah in primerjava njihovih genomov vsaj doslej ni postregla z jasno razlago te sposobnosti. Dejavniki virulence so pri glivah nasploh mnogo manj jasni kot pri bakterijskih patogenih, poleg tega pa so redke in nepovezane okužbe posebej dovzetnih posameznikov, na primer imunsko oslabljenih ljudi, z evolucijskega vidika glive skoraj zagotovo zanemarljiv dogodek, posledično pa tudi morebitne prilagoditve nanje. Da bi primerjava oportune patogeneze in ekstremotolerance dobila še večjo težo, se oba fenotipa statistično značilno pojavljata v istih delih glivnega filogenetskega drevesa. Zapisano poenostavljeno: zdi se, da splošna sposobnost preživetja v stresnih pogojih glivam pomaga tudi takrat, ko se znajdejo v človeškem telesu in so izpostavljene stresu našega imunskega odziva.
S tem pa naše potovanje po genomiki gliv iz ekstremnih okolij še zdaleč ni končano. Primerjava sorodnih genomov nam omogoča priti do ugotovitev, ki so na podlagi enega samega genoma nedosegljive. Tako smo ugotovili, da hibridni genom črne kvasovke H. werneckii ni izjema, temveč je večina sevov te vrste diploidnih in sestavljenih iz dveh nepričakovano različnih haploidnih genomov, četudi se vrsta razmnožuje izključno nespolno – in to nenavadno strategijo razmnoževanja ravno v teh dneh preučujemo na podlagi genomov več kot šestdesetih naravnih izolatov te kvasovke. Ali je takšno razmnoževanje povezano z ekstremotoleranco te vrste, zaenkrat ostaja neznanka. Ravno nasprotno sta sekvenciranje in primerjava sto genomov vrst A. pullulans, W. ichthyophaga in Wallemia mellicola nakazala visoko stopnjo rekombinacije znotraj vrst, četudi so te do tedaj veljale za nespolne. Posamezni sevi, četudi izolirani z različnih delov sveta in v primeru vrste A. pullulans tudi iz izjemno različnih habitatov, tvorijo homogene populacije brez združevanja v podskupine, ki bi nakazovale morebitno specializacijo za določen tip habitatov ali nastajanje novih vrst zaradi geografske izolacije. Zlasti v primeru kvasovke A. pullulans, ki jo najdemo skoraj povsod, od površine rastlin in hišnega prahu do rezervoarjev za letalsko gorivo in arktičnih ledenikov, ti podatki kažejo, da je vrsta pravi generalist in se je brez specializacije na genomski ravni sposobna prilagoditi prav osupljivemu naboru okoljskih razmer. Ker ima ta kvasovka številne možnosti biotehnološke uporabe in uporabe v kmetijstvu za biokontrolo bakterijskih in glivnih patogenov, je razumevanje njene biologije še posebej pomembno – še zlasti, če ga lahko dopolnimo z metodami, ki segajo onkraj genomike, pri čemer klasična in molekularna biologija ostajata nepogrešljivi.
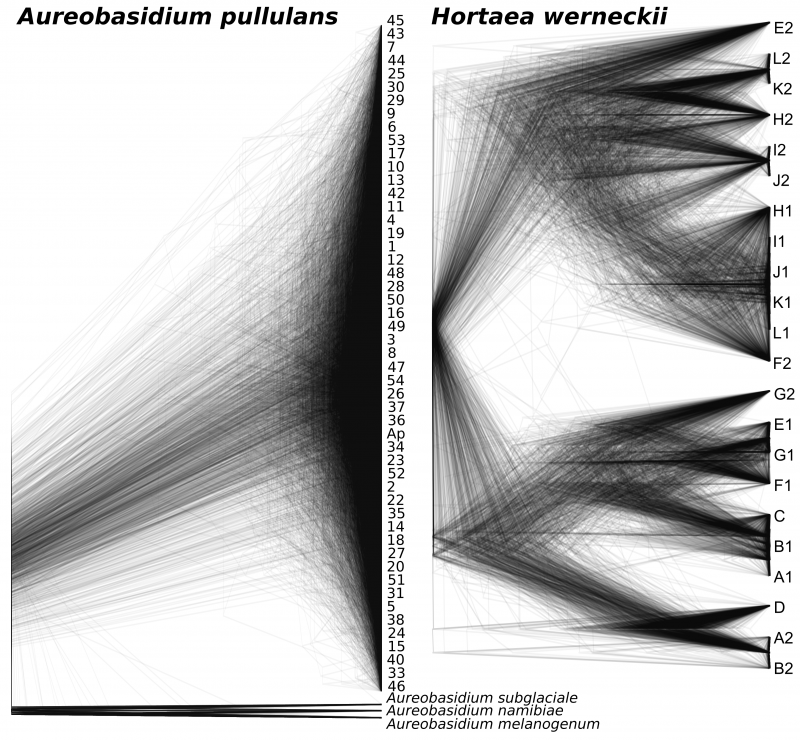
Podobnost med genskimi drevesi je odraz stopnje rekombinacije med sevi znotraj vrste. Pri črni kvasovki Aureobasidium pullulans (levo) je rekombinacija pogosta, črna kvasovka Hortaea werneckii (desno) pa se razmnožuje nespolno, zaradi česar je topologija genskih dreves različnih genov podobna.
In v tej smeri tudi nadaljujemo naše raziskovalno delo. Sekvenciranje in preučevanje genomov postaja vse bolj naše vsakdanje orodje za razumevanje prilagoditev organizmov na stres. To orodje ni niti vsemogočno niti edino ki ga imamo na razpolago. Je pa izjemno zmogljivo in vse bolj nepogrešljivo. V desetletju genomike gliv iz ekstremnih okolij nam je poleg ponujenih odgovorov zastavilo tudi mnogo vprašanj. In prav ta vprašanja so se mnogokrat izkazala za veliko bolj dragocen rezultat, kot smo si ob začetku sekvenciranja genomov predstavljali.















