Dolgo je veljalo, da sta naše življenje in usoda odvisna pretežno od dednih zasnov v naših genih oziroma zapisa DNK. Znanost je bila o tem prepričana, zato so začeli v poznih osemdesetih letih prejšnjega stoletja raziskovalci izpeljevati projekt človeškega genoma. Na presenečenje vseh se je izkazalo, da je število genov, ki se prevedejo v proteine, glavne izvrševalce nalog v celici, pri človeku zelo majhno (od 20.000 do 25.0000, medtem ko je bilo pričakovano število 100.000) in primerljivo s številom genov v manj kompleksnih organizmih, kot so paraziti. Kako je torej mogoče, da smo ljudje tako kompleksna bitja, čeprav imamo le 20.000 genov? Odgovor se ne skriva v številu genov, ampak v aktivnosti in kompleksnosti delovanja genov. Ni pomembno samo, kaj piše v našem genomu. Ključno je tudi, ali je mesto v DNK sploh delujoče v določenem trenutku, ali se aktivno prepisuje, ali tvori aktiven protein, ali ima kakšen biološki učinek. Samo zaporedje DNK torej predstavlja le enega izmed različnih nivojev, ki nas določajo, in nam pove premalo, če želimo obravnavati človeka kot celoto. Glede na to, da naša »usoda« ni v celoti zapisana v genih, kot smo to nekoč verjeli, se sedaj poraja vprašanje, ali imamo sami na to kakršenkoli vpliv. Odgovor je pritrdilen, saj našemu dednemu zapisu lahko kljubujemo tako, da spremenimo aktivnost genov. Gre za koncept, poznan pod imenom epigenetika, ki predstavlja spoznanje, da lahko na izražanje genov vplivajo tudi dejavniki okolja, pri tem pa se zapis DNK ne spremeni. Celotnega pomena epigenetike trenutno še ne poznamo, vemo pa, da škodljivi vplivi iz okolja in slabe navade pomembno vplivajo na utišanje ali pretirano izražanje nekaterih genov in posledično na naše zdravje in počutje. Toda ali s svojim življenjskim stilom lahko vplivamo tudi na zdravje naših potomcev?
Genski zapis
Da bi lahko odgovorili na zgornje vprašanje in če želimo lažje razumeti napisano, si najprej poglejmo, kaj sploh so geni oziroma genski zapis. Nosilka dednega oziroma genskega zapisa v vseh živih organizmih (z izjemo nekaterih virusov) je DNK (deoksiribonukleinska kislina). DNK je dolga molekula, sestavljena iz nukleotidov (sladkorna enota, dušikova baza in fosfatne skupina), ki se med seboj povezujejo v dve verigi in tvorijo značilno obliko dvojne vijačnice. Nukleotidi se medseboj razlikujejo v vrsti dušikove baze, poznamo jih namreč štiri: adenin, citozin, gvanin in timin. Zaporedje različnih nukleotidov pa določa pomen genetske informacije. Pri evkariontih se molekula DNK nahaja v jedrih celic in nabor vseh jedrnih molekul DNK v organizmu sestavlja genom. Da celica lahko uspešno opravi svoje naloge, se mora molekula DNK najprej prepisati v informacijsko molekulo RNK (ribonukleinska kislina), nato pa prevesti v proteine - kompleksne molekule, ki opravijo večino dela v celicah in v našem telesu. Vsaka sekvenca DNK, ki vsebuje informacijo oziroma navodilo za prevod v protein, se imenuje gen. Osrednjo vlogo molekule DNK kot nosilke genskega zapisa so z odkritjem njene strukture leta 1953 potrdili Rosalind Franklin, James Watson in Francis Crick, kar obeležujemo tudi kot rojstvo sodobne molekularne biologije.
Povsem razvita molekula DNK bi v dolžno merila približno 2 metra, medtem ko je jedro, v katerem se celica nahaja, kar 400.000-krat manjše. Če si sedaj predstavljamo, da ima človek povprečno 37×1012 celic (Bianconi idr. 2013) in bi verige DNK iz vseh celic sestavili skupaj, bi skupno namerili 7×1013 metrov, kar je enako kot približno 200 potovanj z zemlje na sonce in nazaj. Da se lahko molekula DNK »stlači« v tako majhen prostor v celičnem jedru, so potrebne posebne strukture oziroma proteini, imenovani histoni, na katere se veriga DNK lahko navije. Osem histonov skupaj z navito molekulo DNK imenujemo nukleosom. Nukleosomi so osnovna enota kromatina, ki sestavlja kromosom (kot je prikazano na spodnji sliki). Vsa človeška DNK je skupaj zvita v 23 parov kromosomov, čemur s skupnim imenom pravimo človeški genom.
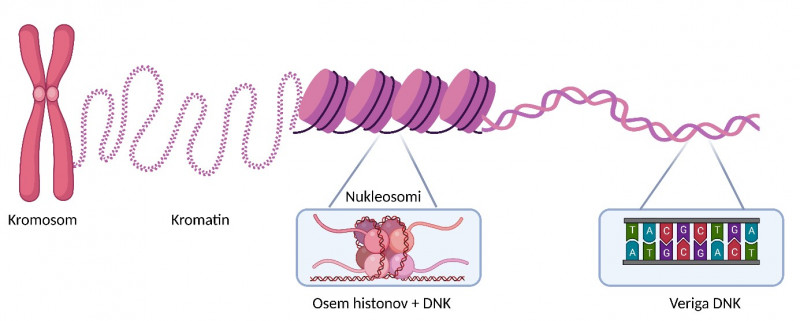
Veriga DNK je sestavljena iz nukleotidov, ki se med seboj povezujejo v verigo. Molekula DNK se v jedru navije na posebne strukture, imenovane histoni. Osem histonov skupaj z navito molekulo DNK tvori nukleosom, ki je osnovna enota kromatina.
Projekt človeški genom
Dolgo obdobje v zgodovini so bili raziskovalci, predvsem genetiki, povsem prepričani, da se vsi odgovori na pomembna biološka vprašanja skrivajo v dednem zapisu. Veljalo je splošno prepričanje, da ko bomo enkrat razvozlali in prebrali celotno zaporedje človeškega genoma, bomo povsem razumeli kompleksnost človeka, pojasnili vse mehanizme nastanka genetskih bolezni, vplive genov na naše zdravje in še mnogo več. Na presenečenje vseh se je izkazalo, da ima človek v resnici trikrat manjše število genov kot parazit Trichomonas vaginalis, odgovoren za urogenitalne okužbe. Hitro nam je postalo jasno, da razlike v kompleksnosti med organizmi ne nastanejo zaradi razlik v številu kodirajočih genov, ampak v njihovi kompleksnosti delovanja, kar je posledica izražanja in aktivnosti določenih genov v določeni celici v določeni časovni točki. Izkaže se, da vsi geni niso vedno aktivni, čeprav imamo v DNK zapis za njihovo izražanje, in so lahko tudi utišani, kar lahko pojasnimo s pojmom epigenetike.
Epigenetika
Epigenetika je področje molekularne biologije, ki preučuje spremembe v izražanju genov, nepovezane s spremembami v zaporedju DNK. Obsega dve glavni vrsti sprememb, in sicer metilacijo DNK ter modifikacijo histonov. Pri metilaciji gre za dodatek metilne skupine na citozinske baze, ki sestavljajo molekulo DNK. Ta sprememba deluje kot oznaka, naj se del molekule DNK, ki je trenutno aktiven – torej razvit in dostopen za encime in proteine, ki omogočajo prepis in prevod gena v protein – močneje zavije, postane nedostopen za encime in tako manj aktiven ali povsem neaktiven. Z odstranitvijo metilne skupine (demetilacija) pa se lahko del DNK ponovno razvije, zopet postane dostopen in tako aktiven. S pomočjo metilacije lahko celica določene gene povsem utiša, kot da jih sploh ne bi bilo, čeprav so še vedno prisotni v njenem zapisu DNK. Druga vrsta epigenetskih sprememb obsega modifikacije histonov, vključno z metilacijo, acetilacijo, fosforilacijo, ubikvitinacijo in drugimi. Pri vseh histonskih modifikacijah se specifična funkcionalna skupina (npr. metilna, acetilna) veže na točno določen aminokislinski del histonskega repka, kar spremeni njegovo strukturo in lastnosti ter vpliva na interakcije med histoni in molekulo DNK. Pogosto je razlog sprememba elektrostatskega naboja, kar vpliva na ohlapnost ali tesnost navijanja molekule DNK okrog histonov. Od tega je potem odvisno, ali se bo določen gen prepisal in izražal ali ne. Spremembe na histonih si lahko predstavljamo kot gumb, s katerim celica uravnava jakost izražanja posameznega gena, medtem ko je metilacija DNK bolj podobna stikalu za vklop ali izklop določenega gena.
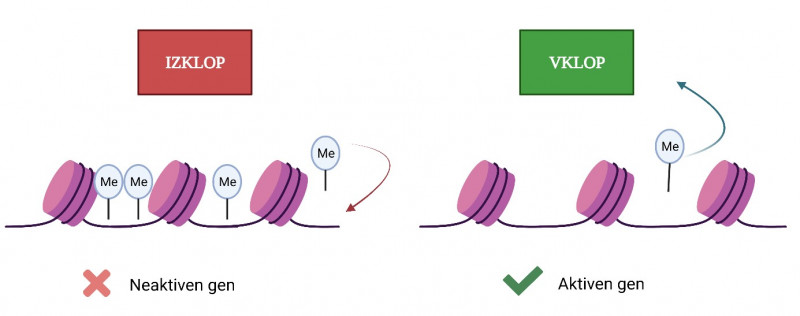
Metilacija DNK: S pomočjo metilacije (dodatek metilne skupine na zaporedje DNK) lahko celica določene gene povsem utiša (levo), kot da jih sploh ne bi bilo, čeprav so še vedno prisotni v njenem zapisu. Z odstranitvijo metilne skupine pa se lahko del DNK ponovno razvije, gen pa postane aktiven (desno). Metilacijo si lahko predstavljamo kot stikalo za vklop ali izklop določenega gena.
Z razumevanjem epigenetskih sprememb si lahko pojasnimo, zakaj imajo vse celice v našem telesu povsem enak dedni zapis, čeprav se povsem razlikujejo po obliki (fenotipu) in nalogi, ki jo opravljajo. Živčne celice na primer opravljajo povsem drugačno nalogo kot rdeče krvne celice. Ti dve celici se povsem razlikujeta tudi po obliki, čeprav imata povsem enak DNK zapis. Rdeča krvna celica s pomočjo epigenetskih sprememb povsem aktivira vse gene, ki so pomembni za opravljanje njenih nalog, medtem ko ima vse gene, ki so bolj pomembni za opravljanje nalog živčne celice metilirane in zato neaktivne oziroma utišane. Rdeča krvna celica ima tako gene za proizvodnjo hemoglobina povsem nemetilirane, zato se izražajo, so aktivni, se prepisujejo in prevedejo v protein – hemoglobin. Nasprotno so geni za hemoglobin v živčnih celicah povsem metilirani, se ne izražajo in tudi ne tvorijo produkta – proteina.
Okolje, prehrana in epigenetika – vpliv na potomce
Poznamo številne dejavnike iz okolja, ki vplivajo na aktivacijo ali utišanje določenih genov, kot so prehrana, telesna aktivnost, stres, delo v nočnih izmenah, interakcije z drugimi ljudmi, izpostavljenost težkim kovinam, pesticidom, tobačnemu dimu, radioaktivnosti in okužbe z virusi in bakterijami. Izpostavljenost nekaterim neugodnim ali škodljivim dejavnikom torej vpliva na naše počutje in zdravje, kar je povezano z razvojem epigenetskih sprememb in posledično tudi nekaterih bolezni, kot so sladkorna bolezen, srčno-žilne bolezni, nevro-degenerativne bolezni in rakava obolenja. Dokazano je tudi že, da okolje ne vpliva samo na naše zdravje, ampak v času nosečnosti lahko vpliva tudi na plod. Če ženska med nosečnostjo kadi, se nezdravo prehranjuje ali je pod stresom, to vpliva tudi na še nerojenega otroka. Signali iz okolja se prenesejo na plod in vplivajo na vzpostavitev metilacije in drugih epigenetskih sprememb v celicah otroka, kar vpliva na njegovo zdravje in tveganje za razvoj različnih kroničnih bolezni tudi v odrasli dobi. Ena izmed obsežnejših raziskav, ki je potrdila vpliv lakote matere med nosečnostjo na potomce v odrasli dobi, je vključevala posameznike, ki so bili rojeni na Nizozemskem med leti 1944 in 1945, v obdobju t. i. nizozemske zime lakote. To je bilo 5-mesečno obdobje, ko je tamkaj živeče prebivalstvo živelo v hudem pomanjkanju in je za posledicami stradanja umrlo več kot 20.000 ljudi. Raziskovalce je zanimal dolgoročen vpliv stradanja med različnimi gestacijskimi obdobji matere (od spočetja do rojstva otroka) na zdravje in življenje njenih potomcev v odrasli dobi. Med potomci, ki so bili lakoti izpostavljeni v zgodnjem prenatalnem razvoju, je bilo večje število predebelih v primerjavi s splošno populacijo. Poleg tega so imeli večje tveganje za razvoj sladkorne bolezni, ateroskleroze in srčno-žilnih bolezni, kar so povezali z epigenetskimi spremembami v genomu, predvsem z razlikami v vzorcih metilacije DNK na genih, vpletenih v metabolne poti in celično diferenciacijo (Painter idr. 2005; Lumey idr. 2011).
Spoznali smo torej, da okolje, kateremu smo izpostavljeni med zgodnjim razvojem, zelo pomembno vpliva na epigenetske spremembe, ki se lahko ohranijo tudi v odrasli dobi. Vendar pa je še bolj pomembno vprašanje, ali lahko ženske s svojim življenjskim stilom vplivajo na zdravje svojih otrok in vnukov tudi v času, ko niso noseče, in kako lahko na to vplivajo moški v različnih življenjskih obdobjih?
Ideja, da bi življenjski slog v zgodnejših obdobjih človeka, mnogo preden postane starš, vplival na zdravje potomcev, tako otrok kot tudi vnukov, se mnogim zdi zelo vprašljiva. Čeprav obstaja za prenos epigenetskih sprememb med generacijami že nekaj dokazov iz različnih živalskih modelov, so tovrstne epidemiološke študije na ljudeh zelo redke predvsem zaradi logističnih, časovnih, finančnih in etičnih omejitev. Poleg tega težko zaključimo, da so spremembe res posledica prenosa epigenetskih označb na potomce in ne drugih dejavnikov, kot so okoljski, demografski ali kulturni. Obstajajo pa študije, ki nakazujejo, da je medgeneracijski prenos epigenetskih sprememb možen. Ena izmed takšnih študij je preučevala ljudi, ki so preživeli holokavst med drugo svetovno vojno in njihove odrasle potomce. Vključili so posameznike, ki so bili ali zaprti v nacističnih taboriščih ali doživeli ali bili priča mučenju med vojno. Za primerjavo so v raziskavo vključili posameznike, ki med drugo svetovno vojno niso živeli v Evropi in niso doživeli oziroma bili priča kakršnemukoli mučenju. Vsi udeleženci so nato izpolnili vprašalnike, kjer so ocenili svoje počutje, zdravje in pogostost uživanja drog ali različnih zdravil. Ugotovili so, da imajo potomci mater (ne pa tudi očetov), ki so bile izpostavljene mučenju ali zaprtju v koncentracijskem taborišču, več čustvenih težav, povezanih z doživljanjem stresnih dogodkov, in tudi več zdravstvenih težav. Prav tako je več omenjenih potomcev poročalo o pogostem uživanju psihotropnih drog in zdravil za zniževanje pritiska in holesterola v primerjavi s kontrolno skupino (Flory idr. 2011). Tako pri starših, ki so preživeli holokavst, kot tudi pri njihovih potomcih so odkrili podobne vzorce metilacije na genu, ki kodira protein, vpleten v uravnavanje odziva na stresne dogodke, ki so se razlikovali od vzorcev metilacije na istem genu pri kontrolni skupini staršev in otrok (Yehuda idr. 2016). Pri posploševanju zaključkov omenjenih študij moramo biti sicer zelo previdni, saj imata več pomanjkljivosti. Vključenih je bilo relativno majhno število posameznikov (32 staršev in 22 potomcev), avtorji niso opredelili njihove natančne starosti in časa izpostavljenosti mučenju oziroma časa, preživetega v taborišču, med kontrolno in preučevano skupino so bile statistične razlike v letih in spolu, povezave pa so potrjevali na podlagi vprašalnika za samoocenjevanje, ki ga avtorji v omenjenih člankih ne predložijo, niti ne navedejo natančno, katera vprašanja so bila vključena.
Naslednja študija, ki je bila objavljena v prestižni znanstveni reviji Nature, je z vidika zasnove, metod in rezultatov znanstveno bistveno bolj neoporečna. V študiji so raziskovalci spremljali potomce 239 prebivalcev pokrajine Norrbotten, najbolj zahodne dežela na Švedskem, rojenih v letih 1890, 1905 in 1920. Norrbotten je redko poseljena in oddaljena pokrajina, kjer v 19. stoletju ni bilo nobenih prometnih povezav z drugimi deli države. Ko je bila letina žita v pokrajini slaba, so ljudje stradali, saj niso imeli možnosti potovati drugam, medtem ko so se med obilno letino prenajedali. V 19. stoletju je lakota udarila deželo v nepredvidljivem vzorcu približno vsako desetletje. Z zbiranjem zgodovinskih, agrikulturnih in medicinskih podatkov so znanstveniki preučevali, kako so obdobja lakote ali prenajedanja pri dečkih ali deklicah v času razvoja spolnih celic (med 8. in 10. letom pri dekletih in 9. ter 12. letom pri dečkih, v obdobju upočasnjene rasti, tik pred nastopom pubertete) vplivala na zdravje njihovih dveh generacij potomcev (otrok in vnukov). Ugotovili so, da so imeli otroci in vnuki dečkov, ki so bili stari od 9 do 12 let ravno v obdobju, ko je bilo hrane v izobilju, kar štirikrat večje tveganje za razvoj sladkorne bolezni in srčno-žilnih zapletov ter so v povprečju bolj zgodaj umrli kot vnuki dečkov, ki so to obdobje preživeli v pomanjkanju hrane. Zanimivo je, da ko so bili očetje ali dedki izpostavljeni lakoti, so bili potomci celo zaščiteni pred razvojem sladkorne bolezni in srčno-žilnih zapletov, kar pa ni veljalo za potomce mater, ki so bile izpostavljene lakoti v istem obdobju (Kaati idr. 2002).
Ni vse samo v genih ...
Kot posamezniki se moramo zavedati, da je zapis DNK le ena izmed ravni, ki nas določa in na katero nimamo nobenega vpliva. Druga izmed ravni, ki je izjemno pomembna, pa je epigenom, na katerega lahko pomembno vplivamo s svojim življenjskim slogom in izbiro okolja, v katerem bomo živeli. Epigenetski označevalci so, v nasprotju z zapisom DNK, zelo prilagodljivi in lahko spremenijo aktivnost nekaterih genov pod vplivom zunanjih dejavnikov. Epigenetske spremembe so tako povezane z razvojem številnih bolezni, kot so rakava obolenja, srčno-žilne in nevro-degenerativne bolezni, na kar lahko delno vplivamo tudi sami. Po drugi strani pa so epigenetske spremembe tudi dovolj stabilne, da se lahko prenašajo z ene generacije na drugo, še posebej v času nosečnosti. Vendar pa so raziskave o prenosu epigenetskih sprememb na potomce še v začetni fazi, saj imamo na voljo večinoma le podatke iz preučevanja živalskih modelov, ki pa se ne morejo neposredno prenesti tudi na človeka. Medtem pa je obsežne epidemiološke raziskave na ljudeh izredno težko izvesti in pravilno interpretirati. Kljub temu poskusimo v svoje navade vključiti zdravo prehrano in gibanje na svežem zraku, izključiti pa nezdrave navade (kot so kajenje in pitje alkohola) ter predvsem stres. Tako bomo veliko naredili ne le zase, pač pa tudi za generacije, ki prihajajo.















