Kako raziskovati bolezni, ne da bi komu škodovali? Dolga desetletja so znanstveniki odgovore iskali v celičnih kulturah – v laboratorijskih posodicah (petrijevkah), kjer človeške celice rastejo, se delijo in se odzivajo na zdravila. Sprva so bile to preproste dvodimenzionalne plasti celic, danes pa raziskovalci ustvarjajo tridimenzionalne »miniaturne organe«, ki lahko posnemajo delovanje človeškega telesa. Ti celični modeli obetajo revolucijo v sodobni biomedicini, a prinašajo tudi nova vprašanja: kako zanesljivi so, v kolikšni meri lahko nadomestijo žive organizme in ali bomo nekoč res lahko opustili poskuse na živalih?
Da bi res razumeli pomen tridimenzionalnih modelov, moramo poznati tudi njihove omejitve, razvoj skozi čas in prihodnje možnosti njihove uporabe. Tradicionalni razvoj zdravil, ki je zgodovinsko temeljil na dvodimenzionalni (2D) celični kulturi in živalskih modelih, je časovno in finančno zelo zahteven. Razvoj zdravila danes traja več kot desetletje in stane več milijard dolarjev, pred začetkom kliničnih preizkušanj pa je treba zdravila testirati na vsaj dveh živalskih modelih. Do velike spremembe na tem področju je prišlo decembra 2022, ko je FDA dovolila odobritev zdravil brez preverjanja učinkovitosti na živalskih modelih. S tem je odprla pot in spodbudila razvoj naprednih tridimenzionalnih (3D) modelov, ki bi lahko nadomestili živalske modele, hkrati pa učinkovito napovedovali odziv na zdravilno učinkovino. V tem članku bova opisali različne celične modele, njihove prednosti in slabosti ter kaj na tem področju prinaša prihodnost.
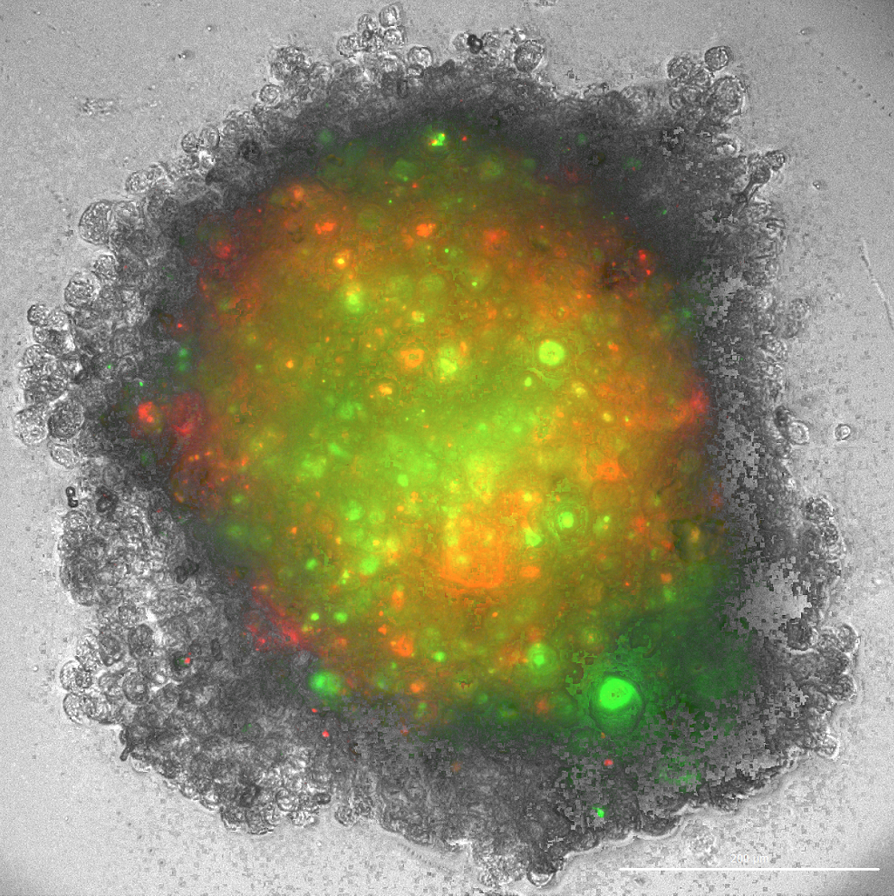
Slika 1: Tridimenzionalni sferoid, sestavljen iz kokulture glioblastomskih celic (zelena barva) in makrofagov (rdeča barva). Levo: Slika brez svetlobnega polja. Desno: Sferoid pod svetlobnim poljem.
Vrste celičnih modelov
Celični modeli so poenostavljeni eksperimentalni sistemi, sestavljeni iz več celic, s katerimi želimo posnemati določene bolezni ali fiziološke procese. V začetnih fazah testiranja novih zdravil so nepogrešljivi in nujni, hkrati pa omogočajo raziskovanje molekularnih mehanizmov, interakcij med različnimi celicami itd. Različni celični modeli se močno razlikujejo med sabo, predvsem po svoji kompleksnosti in uporabnosti.
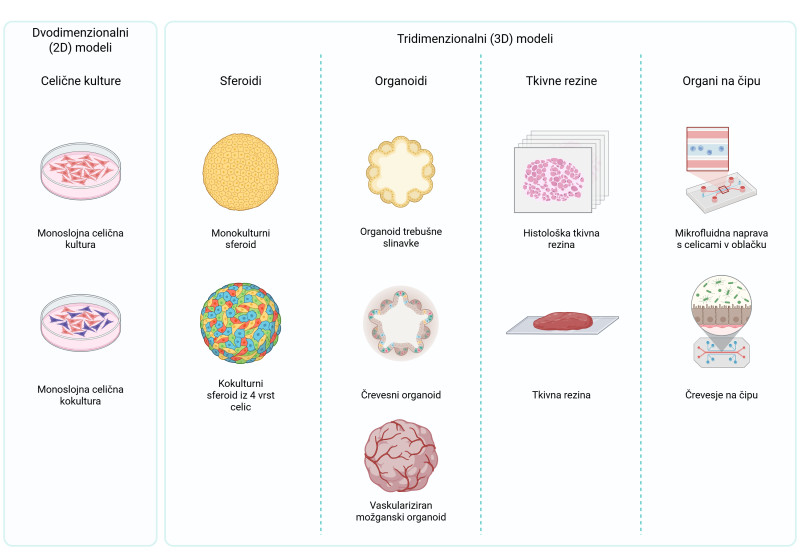
Slika 2: Shematski prikaz različnih vrst celičnih modelov. Ustvarjeno s programom BioRender.
Tradicionalno se je zdravila v predkliničnih poskusih testiralo na dvodimenzionalnih celičnih modelih, ki jih običajno gojimo v petrijevki, kjer celice rastejo v eni plasti na ravni površini. Ti modeli so enostavni za uporabo, stroškovno ugodni in dobro opisani v strokovni literaturi, zato omogočajo visokozmogljivostno testiranje zdravil in ponovljive rezultate. Kljub temu pa imajo nezanemarljive omejitve: celice v njih namreč rastejo v dveh dimenzijah, kar poenostavi njihovo biološko okolje in pogosto vodi do optimističnih rezultatov, ki pa se v kliničnih poskusih ne potrdijo. Dvodimenzionalni modeli namreč ne posnemajo niti arhitekture tumorja niti tumorskega mikrookolja, prav tako nimajo gradienta hranil in kisika. Da bi lahko natančneje napovedali odziv tumorja na zdravilo in opisali naravo bolezni, so raziskovalci začeli razvijati nove celične modele, ki bi bili kompleksnejši in bi bolezen bolje posnemali. Danes tako poznamo več različnih tridimenzionalnih modelov, kot so sferoidi, organoidi, pridobljeni iz tumorskega tkiva, kulture tkivnih rezin in organi na čipu. Sferoidi so tridimenzionalne celične kulture oziroma skupki, ki nastanejo ob ustreznem gojenju celic, organoide pa razvijemo neposredno iz posameznega tkiva (npr. tumorja), lahko tudi iz matičnih celic. Medtem ko so sferoidi običajno sestavljeni iz enega tipa celic, so v organoidih prisotni različni tipi celic, kar pomeni, da bolje posnemajo kompleksnost človeških organov.
Še naprednejši tridimenzionalni model so t. i. kulture tkivnih rezin. Gre za tanke rezine, ki jih s posebno napravo pripravimo iz tkiva, nato pa jih gojimo in ohranjamo žive v posebnem gojišču. Njihova prednost je v tem, da omogočajo zelo dobro ohranjanje izvornega tumorskega mikrookolja in njegove naravne zgradbe. Najnaprednejši med tridimenzionalnimi modeli pa je organ na čipu, pri katerem celice rastejo na posebni ploščici, ki omogoča natančno nadzorovanje tekočin v modelu (t. i. mikrofluidika) in ki ponazarja dinamično okolje, podobno pogojem in vivo. V en čip lahko povežemo več različnih celičnih tipov in tako ustvarimo funkcionalne modele organov.
Uporaba celičnih modelov
Največji preskok v uporabi celičnih modelov predstavlja premik od dvodimenzionalnega monosloja h kompleksnejšim tridimenzionalnim modelom. Klasične dvo- in tridimenzionalne celične kulture se uporablja za raziskovanje bioloških, kemijskih in molekularnih poti, medtem ko se in vitro tridimenzionalne modele lahko uporablja v tkivnem inženiringu in za raziskovanje sprememb, interakcij in signalizacije v patoloških stanjih, kot je denimo rak.
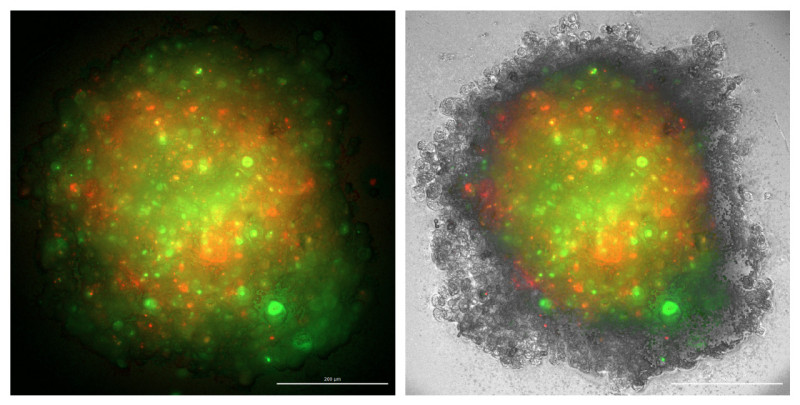
Slika 3: Tridimenzionalni sferoid, sestavljen iz kokulture glioblastomskih celic (levo, zelena barva) in makrofagov (sredina, rdeča barva). Desno: združena slika.
Dvodimenzionalne kulture smo več desetletji uporabljali kot modelni sistem za preučevanje celične raznolikosti oziroma heterogenosti in kot orodje za oceno biološke učinkovitosti bioaktivnih molekul. S pomočjo dvodimenzionalnih kultur smo preučevali celično deljenje in druge celične mehanizme ter določili značilnosti raka. Vendar pa so rezultati, pridobljeni na dvodimenzionalnih modelih, izkazali premajhno klinično uporabnost. V nasprotju z dvodimenzionalnimi modeli pa tridimenzionalni modeli natančneje posnemajo strukturo in funkcijo tkiv ter so zato postali ključni del biomedicinskih raziskav. Koristni so predvsem za posnemanje strukture zunajceličnega matriksa tkiva pa tudi kot model za simulacijo medceličnih interakcij med rakavimi in nerakavimi celicami ter celicami in komponentami zunajceličnega matriksa. Uporabljamo jih za preučevanje celičnih procesov, kot so deljenje, migracija oziroma premikanje celic in invazija oziroma prodiranje v okoliška tkiva. Pogosto jih uporabljamo pri testiranju zdravilnih učinkovin. Kompleksnejše tridimenzionalne modele, kot so organoidi, uporabljamo ne samo za modeliranje bolezni, kot so rak (hepatocelularni karcinom, glioblastom, rak prostate in dojke) in nevrodegenerativne bolezni, temveč tudi za molekularno diagnostiko, rešetanje zdravil in personalizirano medicino. Ti sistemi predstavljajo pomemben korak med predkliničnimi raziskavami in kliničnimi preskušanji, saj bi lahko v prihodnosti povezali laboratorijske (in vitro) modele z dogajanjem v živem organizmu (in vivo). Organi na čipu omogočajo izvajanje farmakokinetičnih in toksikoloških raziskav ter natančno oceno učinkovitosti zdravil. Poleg tega omogočajo raziskovanje kompleksnih bioloških procesov, kot so odzivi imunskega sistema na zdravila ali citokine.
Omejitve celičnih modelov
Tridimenzionalni celični modeli so za raziskovanje bolezni naprednejši kot tradicionalni dvodimenzionalni modeli, vendar pa imajo tudi nekatere pomembne omejitve. V tridimenzionalnih celičnih modelih se zaradi pomanjkanja hranil in kisika v središču pogosto razvije območje odmrlih celic (nekrotično jedro), kar lahko vpliva na rast in povzroči zgodnjo diferenciacijo (spreminjanje matičnih celic v bolj specializirane tipe). Za izdelavo tridimenzionalnih celičnih modelov obstaja več različnih pristopov, vendar se znanstveniki še niso povsem poenotili, kateri je najustreznejši. Za gojenje tridimenzionalnih modelov se pogosto uporablja zunajcelično ogrodje. Danes je na voljo veliko različnih ogrodij, vendar so ta pogosto živalskega izvora, kar lahko pri razvoju zdravil za ljudi omejuje njihovo klinično uporabnost. V primerjavi z dvodimenzionalnimi modeli so tridimenzionalni dražji, visokozmogljivostno testiranje zdravil pa bistveno zahtevnejše. Poleg tega so bolj časovno potratni, standardiziranih testov za ocenjevanje učinkovitosti zdravil pa (še) ni. Posledično ti modeli za zdaj ne morejo v celoti posnemati zapletenega delovanja organov ali bolezni.
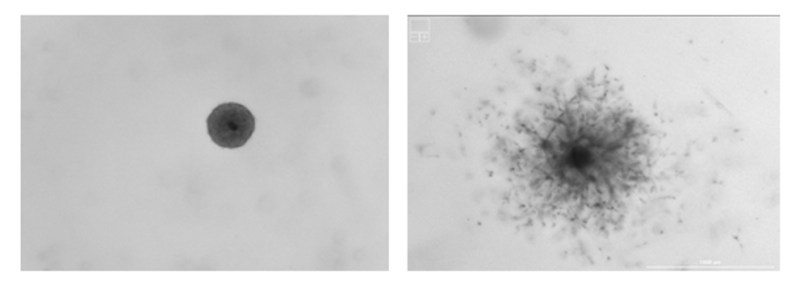
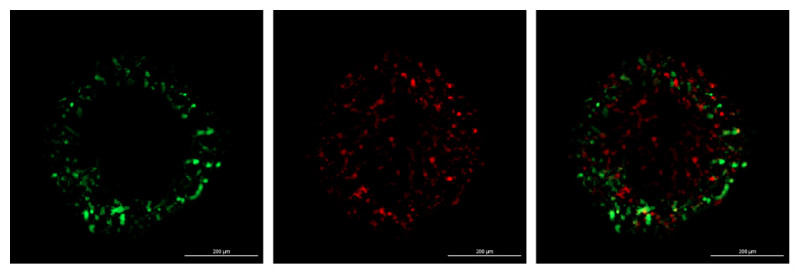
Slika 4: Sferoid pred začetkom invazije (levo) in med njo (desno)
Kam naprej?
Razvoj modelov in vitro sledi napredku in potrebam znanosti. Uporaba celičnih modelov kot sistemov je vsestranska in obsega ponazoritev bioloških procesov, preučevanje mehanizmov delovanja, rešetanje zdravil in napovedovanje odziva na zdravljenje. Organi na čipu kot najnaprednejši model uspešno reproducirajo fiziološke funkcije in okolje človeških organov. Z naglim razvojem umetne inteligence se obeta napredek ne samo pri analizi velikih podatkov in diagnosticiranju bolezni, ampak tudi pri odkrivanju, razvoju in vrednotenju zdravil in vitro. Prehod od dvodimenzionalnih modelov k tridimenzionalnim je spodbujen z željo, da bi se zmanjšala stopnja neuspešnih kliničnih testiranj. Iz plastične posodice s celicami so celični modeli prerasli v miniaturne reprodukcije tkiv in bolezni, ki jih lahko programiramo, zdravimo in opazujemo. Razvoj celičnih modelov izhaja tudi iz etične zaveze k bolj humanemu ravnanju z živalmi in iz cilja, da bi se uporabo živalskih modelov v znanosti postopoma opustilo. Kljub temu so ti trenutno še nepogrešljivi, saj obstoječi modeli ne morejo uspešno reproducirati kompleksnejših obolenj, kot so kardiovaskularne in nevrodegenerativne bolezni.
Z napredkom novih metod in umetne inteligence se odpirajo nova ključna vprašanja. Ali bomo v prihodnosti sploh še potrebovali živalske modele? Bo lahko umetna inteligenca, če bo še naprej napredovala s takšno hitrostjo, napovedovala, kako se bo naše telo odzvalo na zdravilo? Ali bo to pomenilo, da bo neuspešnih kliničnih testiranj manj?