Pandemija COVID-19 je med letoma 2020–2022 sprožila eno večjih revolucij v razvoju cepiv z daljnosežnimi posledicami za razvoj biofarmacevtskega sektorja. Podjetju Moderna in kmalu za tem podjetju BioNTech je namreč v rekordnem času uspelo dokazati klinično uporabnost cepiv, ki temeljijo na tehnologiji mRNK, kar je pripomoglo k zajezitvi pandemije (Kim idr. 2020). Osnova tehnologije mRNK je celični mehanizem prepisovanja genskega zapisa, ki je skupen vsem živim bitjem – določeni gen (molekula DNK) se prepiše v mRNK, ta pa se prevede v protein. Za ključna dognanja, kako tehnologijo mRNK uporabiti kot cepivo, sta Katalin Karikó in Drew Weissman leta 2023 prejela Nobelovo nagrado za medicino.
Klasična cepiva delujejo tako, da imunskemu sistemu zdravega človeka (ali živali) predstavijo antigen, to je motiv, ki je značilen za patogen (patogen je agent, ki povzroča bolezen, npr. virus ali bakterija). Imunski sistem s tem naučimo, da bo prepoznal patogen, ko bo prišlo do okužbe. Antigeni so praviloma proteini, ki jih virusi in bakterije izražajo (nosijo) na svoji ovojnici, zato prvi pridejo v stik z našimi celicami. mRNK predstavlja novo paradigmo cepiv, ki v telo namesto antigena vnesejo zapis zanj. Taka mRNK ima nekaj značilnih lastnosti: prvi nukleotid je t. i. kapa, po kateri človeške celice prepoznajo mRNK kot sebi lastno molekulo (in ne npr. virusno, ki bi jo bilo treba čimprej uničiti). mRNK nosi zapis, ki ga ribosomi prevedejo v proteine, ki so enaki kot antigen patogena, nanje pa se odzove imunski sistem. Ko pride do okužbe z virusom (npr. s SARS‑Cov-2), ki na svoji ovojnici nosi sebi lasten protein (npr. tako imenovani spike protein), je imunski sistem že pripravljen za obrambo in virusne delce uniči ter s tem prepreči obolenje. Ker človeška celica proizvaja (pomnožuje) proteinski antigen iz mRNK, je za cepljenje potreben le majhen odmerek mRNK, praviloma 30–100 μg. Zapisu za antigen sledi še t. i. rep, ki je sestavljen iz dolge verige adenozinov (zato se imenuje poliA rep) in je ključen za stabilnost mRNK v celici. Takšno mRNK zapakiramo v lipidne nanodelce, ki se zlijejo s celično membrano in tako omogočijo lažji vnos v celice, hkrati pa mRNK zaščitijo pred razgradnjo in omogočijo bolj tarčno dostavo v določene organe.
Zaradi uspeha cepiv mRNK pri zaustavitvi pandemije COVID-19 se je od leta 2021 bistveno povečalo število kliničnih študij, ki kot aktivno učinkovino uporabljajo mRNK; v letu 2021 je bilo v teku približno 60 kliničnih študij na mRNK, konec 2024 pa je bilo v kliničnih študijah že skoraj 200 terapij mRNK. Obetavni klinični rezultati se že kažejo pri zdravljenju raka, različnih redkih bolezni, anafilaksije, pri terapijah na osnovi CRISPR-Cas9 (metode, ki omogoča znanstvenikom, da »režejo« genetski material na točno določenih mestih ter po potrebi dodajo oziroma popravijo določene genske sekvence) in drugje.
Tehnologija za proizvodnjo terapevtikov mRNK je po manj kot 4 letih klinične uporabe še vedno v zgodnji fazi razvoja, številni akademski in industrijski laboratoriji po svetu, med drugim razvojni laboratoriji podjetja Sartorius BIA Separations v Ajdovščini, pa nadaljujejo raziskave za povečanje produktivnosti proizvodnje zdravilnih učinkovin mRNK in lipidnih nanodelcev, ki bi omogočili dostopne terapevtike mRNK.
mRNK se proizvaja s kemijsko reakcijo, imenovano transkripcija in vitro (IVT), kar bi lahko razložili kot prepis iz DNK v RNK (obe molekuli uporabljata isti 'jezik' nukleotidov, za proizvodnjo proteinov iz mRNK pa je potreben 'prevod' iz jezika nukleotidov v jezik aminokislin, zato se ta korak imenuje translacija). V reakciji IVT uporabimo zapis DNK kot predlogo za proizvodnjo mRNK, podobno kot je arhitekturni načrt predloga za gradnjo hiše. Vsako cepivo mRNK ima svojo predlogo, in ker so tehnologije za pripravo različnih zapisov DNK že zelo napredne, lahko relativno preprosto in hitro spreminjamo zapis mRNK in s tem vplivamo na učinkovitost cepiva – to je bil tudi eden ključnih faktorjev, da je podjetje Moderna v samo 40 dneh od sekvenciranja genoma virusa SARS-Cov-2 že pripravilo prvo serijo cepiva mRNK, ki je temeljila na zapisu za gen t. i. spike proteina, ki je lasten virusu SARS-Cov-2.
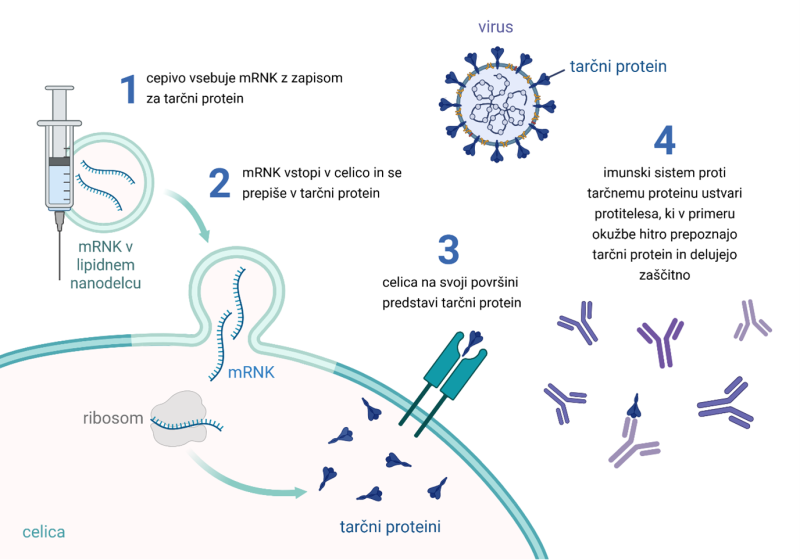
Slika 1: Delovanje cepiv mRNK, avtorica slike: Tjaša Marušič, ustvarjeno z orodjem BioRender
Za pripravo cepiva mRNK potrebujemo poleg DNK-predloge še encim RNK-polimeraza, ki ga lahko v prispodobi gradnje razumemo kot gradbeno ekipo, ki na podlagi načrta zgradi hišo. Potrebujemo tudi opeko – to so štirje osnovni gradniki RNK – adenozin-, uracil-, citozin- in gvanozin-trifosfat (ATP, UTP, CTP, GTP), za malto pa služijo magnezijevi ioni (Milligan idr. 1987). Gradnike, malto in gradbeno ekipo (to so ATP, UTP, CTP, GTP, magnezij, RNK-polimeraza in DNK) mešamo v reakcijski posodi pri določeni temperaturi. Z optimizacijo reakcijskih pogojev, kot so temperatura, pH (kislost oziroma bazičnost raztopine, ki vpliva na delovanje encimov) in količina gradnikov (opeke in malte – ATP, UTP, CTP, GTP in magnezija), lahko reakcijo pospešimo in povečamo njen izkoristek. Po analogiji gradnje lahko o izkoristku reakcije razmišljamo takole: kako lahko z racionalnim načrtovanjem gradnje z isto ekipo in istimi stroji zgradimo več kot eno hišo, morda celo naselje (kar sicer zahteva nekaj več opeke in malte, a prihranimo pri stroških najema in prevoza gradbene ekipe in opreme, kar je bistveno dražje od opeke). Na podoben način smo razmišljali pri optimizaciji reakcije IVT in v zadnjih letih dosegli bistven napredek: če smo leta 2021 lahko proizvedli 5 gramov mRNK na liter raztopine, danes z najnovejšimi postopki dosežemo kar 25 gramov na liter (Boman idr. 2024), pri tem pa smo tudi pokazali na pomembnost izkoristka reakcije – koliko opeke je po zaključeni gradnji ostalo neuporabljene. Pri tem smo stremeli k popolnem izkoristku, da je torej vsa načrtovana opeka tudi uporabljena. To ne le pospešuje proizvodnjo, temveč tudi znatno zmanjšuje stroške na gram mRNK, kar odpira pot k dostopnejšim zdravilom.
Da bi zagotovili čim večjo učinkovitost procesa, želimo proces spremljati kar najbolj natančno, kot gradbeni nadzornik spremlja potek gradnje glede na načrte. Potrebujemo informacije o tem, koliko gradnikov imamo še na voljo v danem trenutku in koliko mRNK smo že proizvedli, da lahko izračunamo, ali nam bo do tarčne količine ostalo dovolj gradnikov. Reakcijo spremljamo z analitsko metodo, ki se imenuje kromatografija in ki temelji na ločbi molekul v raztopini glede na moč vezave na kromatografski nosilec. Ker so gradniki (nukleozid-trifosfati ali NTP) in mRNK močno negativno nabiti, za analizo uporabljamo monolitno kromatografsko kolono s pozitivnim nabojem, ki ločuje med posameznimi gradniki in mRNK. S tako metodo lahko reakcijo IVT spremljamo skoraj sočasno z njenim potekom. Medtem ko tradicionalne tehnike zahtevajo dolge analize in dajejo le delne rezultate, naša rešitev, ki temelji na kromatografski koloni CIMac PrimaS®, v samo treh minutah pokaže, kako hitro se porabljajo gradniki in koliko mRNK nastaja. Takšni hitrost in natančnost analize omogočata učinkovitejše prilagajanje pogojev, kar vodi tudi k optimizaciji proizvodnje (Pregeljc idr. 2023). Če vemo, kako hitro se v reakciji porabljajo gradniki, lahko to izkoristimo tudi za podaljšanje reakcije z dohranjevanjem – opeko pripeljemo na delovišče točno takrat, ko jo potrebujemo, namesto da bi jo za celotno gradnjo od začetka shranjevali na gradbišču – temu bi rekli šaržna reakcija. S pomočjo analitskega spremljanja reakcije smo lahko klasično šaržno reakcijo IVT spremenili v reakcijo z dohranjevanjem gradnikov, kar je dodatno znižalo stroške, saj smo za enak vložek reagentov, ki se ne porabljajo (gradbena ekipa – polimeraza –, in načrt – DNK), z dohranjevanjem cenejših gradnikov (NTP in magnezija) pridobili več mRNK in s tem znižali ceno na gram mRNK (Skok idr. 2022).
Tak pristop k reakciji IVT smo razširili tudi na proizvodnjo drugih tipov RNK, ki imajo terapevtski potencial. Tako smo na primer pokazali, da lahko spremljamo in izboljšamo proizvodnjo tako veliko manjše prenašalne RNK (angl. transfer RNA ali tRNA, ki je več kot 10-krat manjša kot mRNK; Megušar idr. 2023) kot tudi zelo velike samopomnoževalne RNK (angl. self-amplifying RNA, ki je 10-krat večja kot mRNK) in celo krožne RNK (angl. circular RNA), na podlagi katere trenutno začenjajo s kliničnimi študijami za različne terapevtske namene.
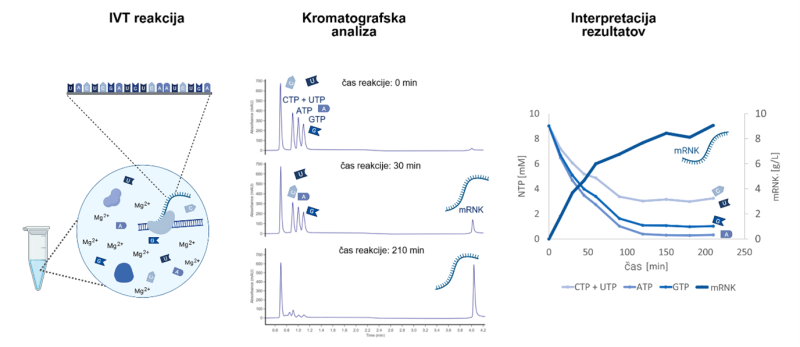
Slika 2: Spremljanje reakcije IVT za proizvodnjo mRNK. Kromatografska ločba gradnikov reakcije (ATP, UTP, CTP, GTP) od produkta (mRNK) omogoča spremljanje poteka reakcije IVT po času. Avtorica slike: Tjaša Marušič, ustvarjeno z orodjem BioRender
Po reakciji IVT je treba mRNK očistiti – ločiti od preostalih gradnikov, RNK-polimeraze in DNK predloge, ki so bili uporabljeni v reakciji. Za čiščenje mRNK se najpogosteje uporablja kromatografija, saj ta zagotavlja visoko specifičnost in posledično visoko čistost končnega produkta. Ker pravilno pripravljene molekule mRNK praviloma vsebujejo poliA rep, lahko za čiščenje mRNK uporabimo osnovni princip dvojne vijačnice DNK, ki sta ga odkrila Watson in Crick: da se nukleotid A veže z nukleotidom T. Če na kromatografski nosilec pritrdimo verigo z več (18–25) zaporednimi deoksitimidini (dT), pride v prisotnosti soli do močne vezave, ki je hkrati zelo specifična za mRNK. Kot sol najpogosteje uporabljamo natrijev klorid, ki jo poznamo kot navadno kuhinjsko sol. Drugi sestavni deli reakcije IVT (npr. NTP, DNK, polimeraza) se na kromatografski nosilec ne vežejo. Ob dodatku vode se očiščena mRNK sprosti s kromatografske kolone. Ta pristop lahko uporabimo tako na mali (laboratorijski) skali kot tudi za velike proizvodne procese, kjer lahko v enem ciklu pripravimo več kot 100 g mRNK (Mencin idr. 2023).
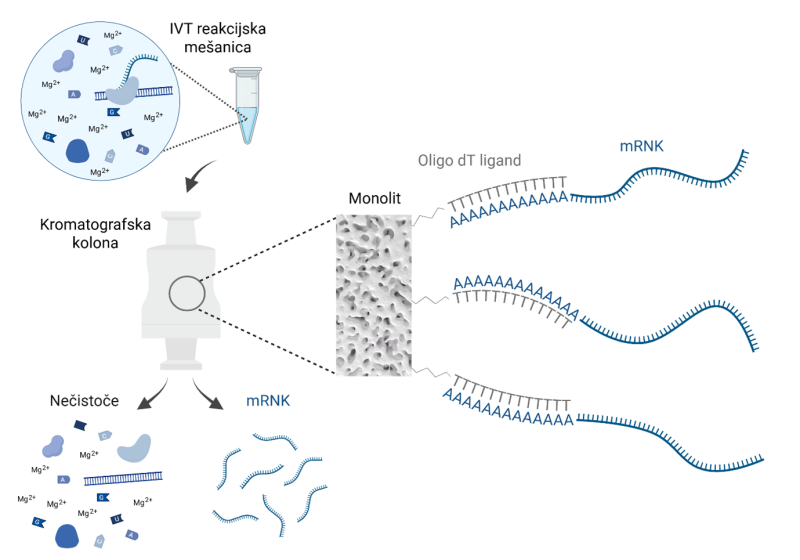
Slika 3: Izolacija mRNK na podlagi selektivne vezave poliA repa na oligo dT ligand, vezan na kromatografsko kolono. Reakcijsko mešanico IVT nanesemo na kromatografsko kolono, ki veže mRNK, ne pa nečistoč. Avtorica slike: Nina Mencin, ustvarjeno z orodjem BioRender
Ena od odprtih tem pri raziskavah mRNK je vpliv nečistoč, ki so stranski produkt reakcije IVT in ki lahko sprožijo neželen imunski odziv. Gre za t. i. dvoverižne RNK, ki jih telo prepozna kot tujek, ker imunski sistem spominjajo na dvoverižne RNK iz virusov (npr. rotavirusa), in ki vodijo k zaustavitvi translacije mRNK, torej delujejo nasprotno želenemu učinku cepiv mRNK. Eden od načinov, kako zmanjšati vsebnost dvoverižne RNK v vzorcu mRNK, je uporaba modificiranih nukleotidov v reakciji IVT, za kar sta Karikó in Weissman prejela Nobelovo nagrado. Drugi način pa je odstranjevanje nečistoč iz mRNK s kromatografijo, in sicer s t. i. reverznofazno kromatografijo, o kateri je prvič ravno tako poročala Katalin Karikó. Reverznofazna kromatografija namesto vode in soli uporablja organska topila in povišano temperaturo, ki razklenejo dvoverižne strukture RNK, ki bi sicer lahko sprožile imunski odziv. Razklenjene verige se lahko potem od tarčne molekule mRNK ločijo po velikosti. Čeprav so odmerki, potrebni za terapevtski učinek terapetikov RNK, bistveno manjši od drugih terapevtskih učinkovin (30–100 μg za cepiva mRNK in 2 μg za cepiva saRNA), smo pokazali, da dodatno čiščenje z reverznofazno kromatografijo za kar 16-krat zviša učinkovitost RNK v celicah, kar pripomore k dodatnemu zniževanju odmerka, ki je potreben za terapevtski učinek (Krušič idr. 2025). Ta pristop za pripravo mRNK ne zahteva uporabe modificiranih nukleotidov in ga lahko uporabimo na mali in veliki skali. Nadaljnje raziskave se osredotočajo na kromatografsko odstranjevanje dvoverižne RNK brez uporabe organskih topil in na optimizacijo pogojev reakcije IVT, ki bi proizvedli manj nečistoč v obliki dvoverižne RNK.
Prihodnja leta bomo priča nadaljnjemu tehnološkemu razvoju cepiv mRNK in zdravil, ki bodo najverjetneje prinesla nove tehnološke preskoke, s tem pa cenejša, bolj dostopna in varnejša cepiva ter zdravila na osnovi mRNK. Raziskave se bodo usmerile v iskanje novih načinov priprave mRNK (npr. v proizvodnjo mRNK v živih celicah namesto s kemijsko reakcijo) in vnosa le-te v celice pa tudi v iskanje novih oblik molekul RNK, ki bodo obstojnejše in bodo za terapevtski učinek potrebovale manjši odmerek. Nadaljeval se bo tako razvoj genskih terapij, ki za zdravljenje genskih bolezni kot aktivno učinkovino namesto virusnega delca uporabljajo mRNK, kot tudi personalizirano zdravljenje raka na osnovi neoantigenskih terapij, pri katerem ponuja mRNK unikatno možnost zelo tarčnega zdravljenja. Osnova kliničnim naporom bo potreba po visoki kvaliteti aktivne učinkovine mRNK, ki bo pripravljena na čim bolj učinkovit način, k čemur smo z našimi raziskavami pripomogli tudi v naših laboratorijih.