Ob besedi tumor se marsikomu naježi koža, saj izraz pogosto enačimo z rakavim obolenjem. A niso vsi tumorji rakotvorni. Beseda izhaja iz latinskega samostalnika tumor v pomenu 'oteklina' oziroma iz glagola tumēre, ki pomeni 'oteči'. Tumor tako v splošnem označuje katerokoli nenormalno tvorbo v telesu, ki je lahko benigna oziroma nerakotvorna ali pa maligna, torej rakotvorna, sposobna širjenja v sosednja tkiva in tvorjenja zasevkov.
Tumorji in njihovo mikrookolje
Rakotvorni tumorji nastanejo v procesu maligne transformacije, ko zdrave celice v svojem genomu kopičijo mutacije in postopoma preidejo v invazivno obliko, ki se nenadzorovano širi. Razvoj tumorja je tako podoben Darwinovi evolucijski teoriji, saj vsaka pridobljena mutacija celicam prinaša selektivno prednost in vodi do progresivne spremembe normalnih celic v rakave.
Takšne tumorje skupaj s krvnimi raki uvrščamo med rakava obolenja, ki so izredno široka skupina bolezni. Zajema več kot 200 različnih vrst raka, ki izvirajo iz raznolikih celic in jih najdemo v različnih tkivih ter organih. Rak tako ni ena sama bolezen, temveč skupek različnih oblik bolezni, med katerimi je vsaka posebna, s svojimi individualnimi lastnostmi. Jasno je, da govorimo o precejšnji heterogenosti, ki pa ji lahko dodamo še vsaj dve plasti kompleksnosti, ko razlikam med vrstami raka dodamo še razlike med tumorji pri različnih posameznikih in razlike med populacijami tumorskih celic znotraj istega tumorja. Hitro ugotovimo, da so tumorji pravzaprav mozaik rakavih celic z raznolikimi lastnostmi, kar jim omogoča prilagodljivost in hkrati prispeva k odpornosti proti različnim vrstam zdravljenja.
Tumor pa ni le skupek tumorskih celic, temveč dinamičen ekosistem neštetih celic, ki skupaj oblikujejo tumorsko mikrookolje. Tumorsko mikrookolje igra pomembno vlogo pri napredovanju tumorja, invaziji okoliškega tkiva in tvorbi zasevkov. V njem lahko najdemo tudi do 50 % nemalignih celic, kot so endotelijske celice, različne celice imunskega sistema, z rakom povezani fibroblasti, maščobne celice ter številne druge tkivno specifične celice, ki imajo z rakavimi celicami večplasten, vzajemen odnos. Ob vsej že omenjeni heterogenosti tako ni presenetljivo, da se sestava in funkcionalno stanje tumorskega okolja med različnimi vrstami raka, stopnjami napredovanja bolezni ter individualnimi značilnostmi bolnika močno razlikujeta. Da pa je zadeva še nekoliko bolj zapletena, se tumorsko mikrookolje razlikuje celo med različnimi zasevki v telesu.
Imunološko hladni in vroči tumorji
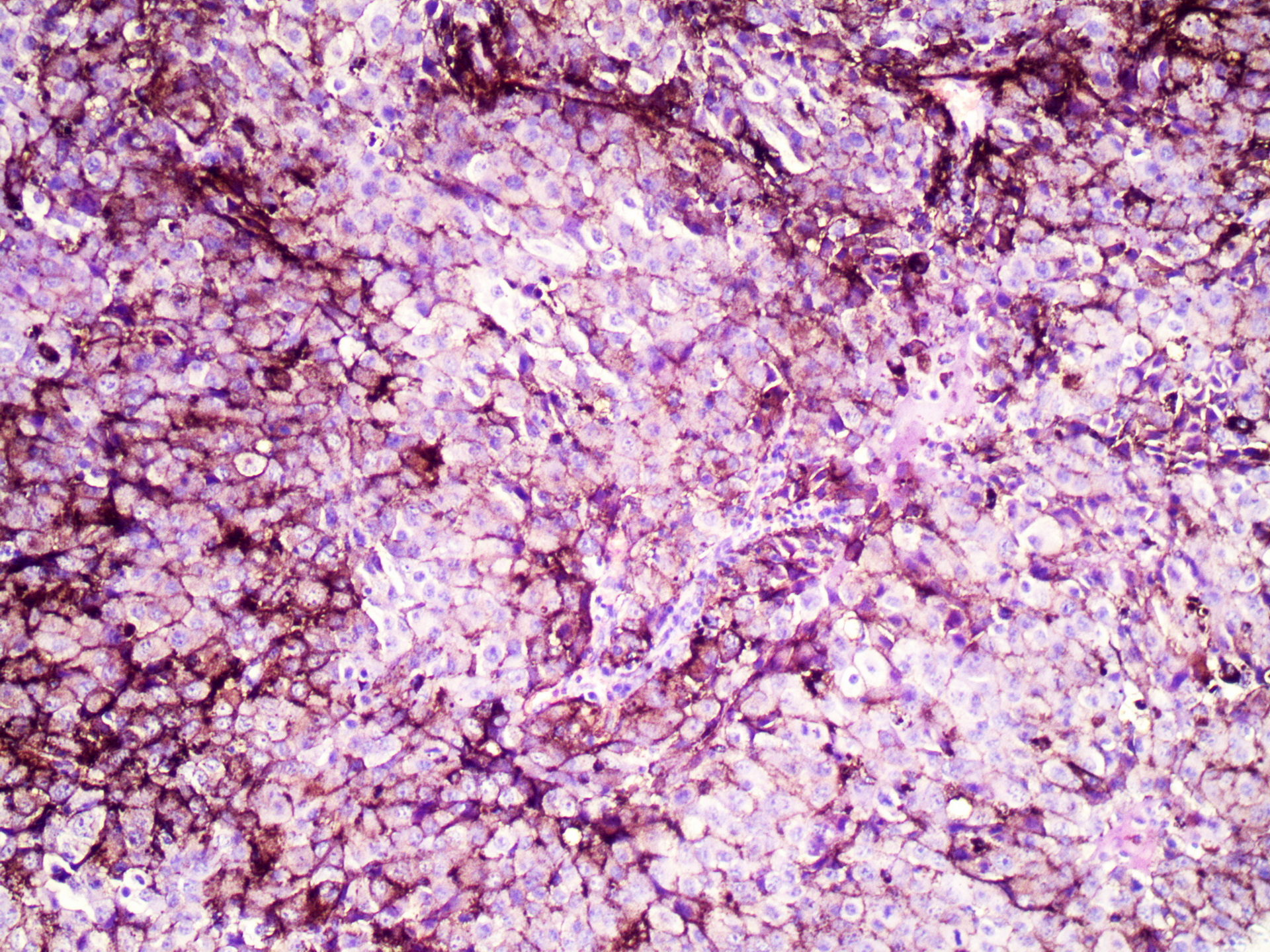
Eden ključnih dejavnikov tumorskega mikrookolja so celice imunskega sistema. V tumorskem mikrookolju najdemo raznolike celice prirojenega in pridobljenega imunskega sistema, ki določajo tako imenovani imunološki potni list tumorja. Če običajen potni list uradnikom na mejah pove, kdo ste in kam potujete, potem imunološki potni list tumorja znanstvenikom in zdravnikom razkrije vrsto, številčnost in lokacijo imunskih celic znotraj tumorja ter deluje kot ključni dejavnik pri napovedovanju odziva tumorja na posamezne terapevtske pristope. Glede na zastopanost imunskih celic v tumorskem mikrookolju ločimo tri glavne imunotipe – imunološko hladne, imunološko spremenjene oziroma izločene in imunološko vroče tumorje.
Kateri terapevtski pristop bi ubrali za zdravljenje posameznega tumorja, je tako zelo odvisno od imunološkega potnega lista posameznega tumorja, hkrati pa je ta tudi glavni razlog, zakaj se učinki zdravljenja med bolniki zelo razlikujejo, čeprav govorimo o isti obliki raka. Imunološko vroči tumorji imajo v svojem mikrookolju prisotnih veliko celic imunskega sistema, močno pa je tudi izražanje različnih signalnih molekul, kot so citokini in kemokini, ki spodbujajo imunski odziv. Takšni tumorji nosijo veliko mutacijsko breme, kar pomeni, da izražajo veliko spremenjenih proteinov – antigenov, ki jih imunski sistem prepozna kot tuje. Tako pravimo, da so imunološko vroči tumorji visokoimunogeni, telo pa proti njim sproži močan imunski odziv, ki je posredovan predvsem s citotoksičnimi celicami, imenovanimi limfociti CD8+ T. To so specializirane celice, ki na podlagi specifičnih antigenov prepoznajo rakavo celico in jo uničijo. Zaradi svoje imunogene narave so imunološko vroči tumorji zelo odzivni na različne imunoterapevtske pristope zdravljenja, ki temeljijo na aktivaciji imunskega sistema, ki prepozna in uniči rakave celice.
Kot nakazuje že poimenovanje, so imunološko hladni tumorji diametralno nasprotje opisanim vročim tumorjem. Ne le da imajo takšni tumorji nizko mutacijsko breme in zato izražajo manj tumorskih antigenov, ki bi jih lahko imunski sistem prepoznal – v njihovem mikrookolju je hkrati tudi zelo malo celic imunskega sistema. Dodatno v takem tumorju najdemo še številne imunske celice, ki zavirajo imunski sistem. Imunološko hladni tumorji so tako nizkoimunogeni in se zato slabo odzivajo na imunoterapijo. Zelo podobne lastnosti imajo tudi imunološko izločeni tumorji, ki so prav tako nizkoimunogeni, čeprav se v njihovem mikrookolju nahajajo določene efektorske celice imunskega sistema, ki pa so prostorsko ločene od tumorskih celic.
Imunska terapija za zdravljenje raka
Rakave celice so razvile številne načine, s katerimi se uspešno izogibajo imunskemu sistemu, poleg tega pa imunske celice tudi izrabljajo v svojo korist. Posledično imunski sistem rakavih celic ne odstrani, čemur sledi razvoj bolezni. Imunoterapija raka predstavlja novo orodje v boju z rakavimi obolenji; temelji na spoznanju, da je imunski sistem ključni regulator tumorske biologije, ki ga je mogoče okrepiti in spodbuditi za boj proti rakavim celicam. Izraz imunoterapija zajema širok nabor terapevtskih konceptov in metod, ki v ospredje postavljajo biološki potni list tumorjev, ki opredeljuje njihove molekularne in imunološke lastnosti, ne le njihovo mesto izvora. Imunološko hladni tumorji predstavljajo za zdravljenje posebno trd oreh, in prav z namenom razvoja terapije, ki bi učinkovala tudi proti takim oblikam tumorjev, smo se v laboratoriju na Odseku za sintezno biologijo in imunologijo Kemijskega inštituta lotili njihovega raziskovanja.
S citokini obogatena celična smrt
Da bi zasnovali inovativno obliko imunoterapije, smo se po navdih obrnili k že znanim signalnim potem prirojene imunosti in zasnovali nov pristop, ki smo ga poimenovali s citokini obogatena piroptoza. Gre za obogateno celično smrt, ki se za svoje delovanje zgleduje po inflamasomih, multiproteinskih strojih v citosolu celic, ki v našem telesu kot odgovor na invazijo škodljivih mikroorganizmov aktivirajo vnetni odziv. Inflamasomi v okuženi celici zaznajo prisotnost mikroorganizmov in sprožijo posebno obliko imunogene celične smrti – piroptozo, pri kateri pride do izlitja vsebine celice in izločanja vnetnih signalnih molekul citokinov, ki spodbudijo imunski sistem. Dvojna aktivnost inflamasomov tako privede do smrti okužene celice in sočasnega lokalnega vnetja, ki na mesto okužbe privlači imunske celice. Podobno je s citokini obogatena piroptoza oblikovana tako, da poleg uničenja tumorskih celic vodi do sproščanja različnih molekul, tumorskih antigenov in drugih imunostimulatornih komponent iz umirajočih celic, te pa spodbudijo tok imunskih celic v tumor in aktivirajo njihovo protitumorsko delovanje.
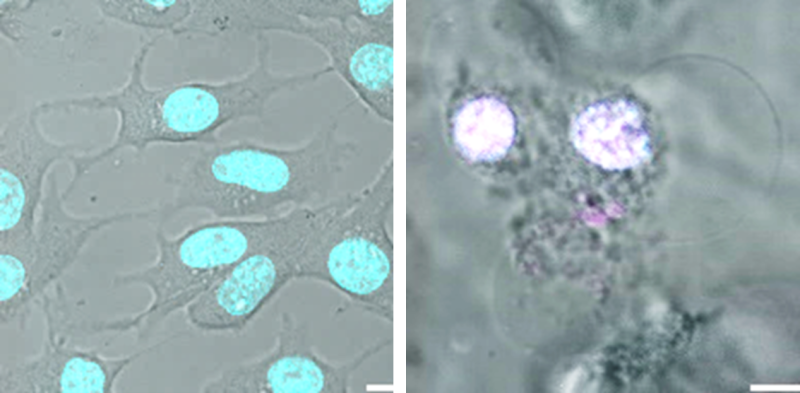
Slika 1: Mikroskopska slika rakavih celic melanoma (levo) in umirajočih celic melanoma z značilno balonu podobno obliko (desno) po zdravljenju s s citokini obogateno piroptozo.
Za sprožitev imunogene celične smrti smo s pomočjo orodij sintezne biologije zasnovali nove oblike proteina gasdermina D, ki v membrani celice tvori pore, jo tako naluknja in povzroči piroptotično celično smrt. Proteinu gasderminu D smo dodali posrednike vnetnega odziva, kot so interlevkin 1β, interlevkin 18 in interlevkin 12. Ti v tumorskem mikrookolju delujejo kot adjuvanti in tako dodatno spodbujajo nastanek imunogenega okolja ter protitumorsko imunost, vse to pa vodi do trajnega odziva proti tumorju.

Slika 2: Prikaz pore gasdermina D (PDB: 6VFE).
Delovanje s citokini obogatene piroptoze smo preizkusili na tumorjih z različnimi imunološkimi potnimi listi, ki smo jim s pomočjo elektroporacije vnesli plazmidno DNK, ki nosi zapis za posamezne terapevtske proteine. Pokazali smo, da aktivacija por gasdermina D v tumorju povzroči piroptotično smrt rakavih celic, terapija pa je bila najbolj učinkovita na modelu mišjega raka debelega črevesa in danke CT26, ki spada pod imunološko vroče tumorje. Pri njem je prišlo do zavrtja rasti tumorjev in dolgotrajne preživelosti pri 80 % zdravljenih miši. To je bilo seveda mogoče pričakovati, saj so v tumorjih z vročim fenotipom prisotne celice imunskega sistema, vendar pa tumorsko mikrookolje zavira njihovo delovanje. Z aktivacijo celične smrti smo tako uspešno preoblikovali imunosupresivno tumorsko mikrookolje in spodbudili delovanje imunskih celic. Terapija je bila uspešna tudi v primeru imunološko hladnih tumorjev, kjer je s citokini obogatena piroptoza na modelu kožnega melanoma B16F10, ki velja za agresivno obliko raka, povzročila regresijo tumorjev in dolgotrajno preživetje 40 % miši. Tako smo pokazali, da s citokini obogatena piroptoza deluje na tumorje ne glede na njihov izvor in imunološki potni list. Poleg tega smo z eksperimenti potrdili, da je za uspešno delovanje s citokini obogatene piroptoze nujna podpora celic imunskega sistema, s čimer smo dokazali, da prav zares govorimo o imunoterapiji raka. Hkrati pa smo pokazali tudi, da s citokini obogatena piroptoza izzove sistemsko protitumorsko imunost, ki jo posredujejo predvsem citotoksične celice CD8+ T in naravne celice ubijalke.
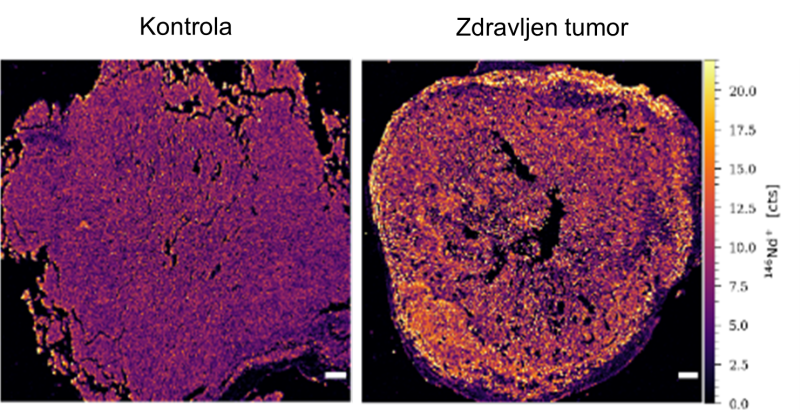
Slika 3: Prerez kontrolnega tumorja melanoma (levo) in s citokini obogateno piroptozo zdravljenega tumorja melanoma (desno), kjer lahko vidimo infiltracijo imunskih celic (rumena barva) v tumor.
Pogled v prihodnost
Končna naloga vseh protirakavih oblik zdravljenja, vključno s kemoterapijo, radioterapijo in imunoterapijo, je selektivno uničenje ter odstranitev rakavih celic s čim manj negativnimi vplivi na zdrava tkiva in organe. Velika težava konvencionalnih terapij ostaja specifičnost, zato je vse več truda vloženega v razvoj strategij, ki usmerjeno uničujejo rakave celice. Največji prispevek, ki ga v naboru novih imunoterapevtskih pristopov prinaša s citokini obogatena piroptoza, je zagotovo njena dvokomponentnost, saj združuje dva izmed ključnih stebrov boja proti raku – aktivacijo imunogene celične smrti in sproščanje molekul, ki spodbujajo imunski odziv proti tumorju in aktivirajo imunske celice. Prav tako lahko s citokini obogateno piroptozo kombiniramo z drugimi, v klinični uporabi že uveljavljenimi oblikami imunoterapije, kot so zaviralci imunskih kontrolnih točk (angl. immune checkpoint inhibitors). Ta novi pristop tako predstavlja kombinatorno in modulatorno strategijo za zdravljenje rakavih obolenj, ki deluje neodvisno od njihovega izvora in imunološkega potnega lista, hkrati pa spodbuja trajen imunski odziv proti tumorju.